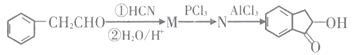
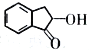
题目内容
【题目】酸雨属于空气污染物,二氧化硫(![]() )的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
a.测得该雨水样品的![]() 为4.73;
为4.73;
b.向雨水样品中滴加![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
c.每隔1h,通过![]() 计测定雨水样品的
计测定雨水样品的![]() ,测得的结果如下表:
,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题。
(1)正常雨水的![]() 为5.6,偏酸性,这是因为________。
为5.6,偏酸性,这是因为________。
(2)分析上述数据变化,你认为形成这一变化的原因是_________。
(3)该兴趣小组同学取某一时段的这种雨水VL,加入![]() 的
的![]() 溶液至不再产生沉淀时,恰好消耗
溶液至不再产生沉淀时,恰好消耗![]()
![]() 溶液。请计算:
溶液。请计算:
①该VL雨水中溶解![]() 的体积(标准状况)为_______。
的体积(标准状况)为_______。
②生成沉淀物的质量m的范围为_________。
【答案】大气中的![]() 溶于雨水中 亚硫酸与空气中的氧气作用转化为硫酸,使雨水的酸性增强 0.448L(或
溶于雨水中 亚硫酸与空气中的氧气作用转化为硫酸,使雨水的酸性增强 0.448L(或![]() )
) ![]()
【解析】
(1)空气中含有CO2,CO2溶于雨水中生成碳酸而使正常雨水偏酸性;
(2)SO2溶于雨水生成亚硫酸,亚硫酸是一种弱酸,从表中可以看出,随着时间的延长,雨水样品的pH逐渐减小,说明雨水酸性逐渐增强,最有可能是亚硫酸被空气中的氧气氧化成硫酸,当亚硫酸全部被氧化成硫酸时,雨水样品的pH不再发生变化;
(3)①由化学方程式![]() ,
,![]() ,可得
,可得![]() ,
,![]() ,由硫元素守恒可得:
,由硫元素守恒可得:![]() ,所以
,所以![]() ;
;
②若生成的沉淀全部是BaSO3,则其质量为![]() ;若生成的沉淀全部是BaSO4,则其质量为
;若生成的沉淀全部是BaSO4,则其质量为![]() ,则
,则![]() 。
。

练习册系列答案
相关题目