题目内容
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:
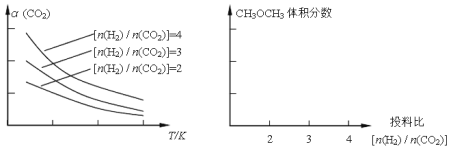
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。
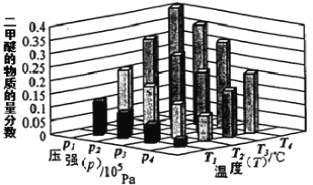
A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
【答案】
(1)CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1
CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1
(2)①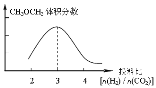 ;② B D
;② B D
(3)K=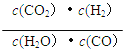 ;放热;75%
;放热;75%
【解析】
试题分析:(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g)△H=-41kJmol-1,
H2(g)+CO2(g)△H=-41kJmol-1,
②C(s)+2H2(g)![]() CH4(g)△H=-73kJmol-1,
CH4(g)△H=-73kJmol-1,
③2CO(g)![]() C(s)+CO2(g)△H=-171kJmol-1,根据盖斯定律,③-①×2+②得:
C(s)+CO2(g)△H=-171kJmol-1,根据盖斯定律,③-①×2+②得:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-162 kJmol-1,
CH4(g)+2H2O(g)△H=-162 kJmol-1,
故答案为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-162 kJmol-1;
CH4(g)+2H2O(g)△H=-162 kJmol-1;
(2)①CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小,故二甲醚的体积分数与投料比的关系为: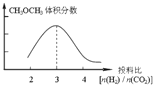 ,故答案为:
,故答案为: ;
;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大,故压强:P1>P2>P3>P4;由图1可知,投料比[n(H2)/n(CO2)]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,二甲醚的物质的量分数减小,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4,故温度:T1>T2>T3>T4,故选:BD;
(3)反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数表达式K=
H2(g)+CO2(g)的平衡常数表达式K=![]() ;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;设CO的浓度变化量为xmol/L,则:
;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;设CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
开始(mol/L):0.02 0.02 0 0
转化(mol/L): x x x x
平衡(mol/L):0.02-x 0.02-x x x
则![]() =9,解得x=0.015,故CO的转化率为
=9,解得x=0.015,故CO的转化率为![]() ×100%=75%,故答案为:
×100%=75%,故答案为:![]() ;放热;75%。
;放热;75%。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案