题目内容
【题目】直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2][Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c molL-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
【答案】
(1)抑制Fe2+水解;确定氧化Fe2+所需H2O2的量;
(2)将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;(3)Fe2(SO4)3+nH2O![]() Fe2(OH)n(SO4)3-n/2+
Fe2(OH)n(SO4)3-n/2+![]() H2SO4;
H2SO4;
(4)①加入最后一滴NaOH标准液,烧杯中液体红色恰好褪去,且30s内不恢复;
②{[56(V0-V)c×10-3]/3ma}×100%。
【解析】
试题分析:(1)Fe2+易水解,实验加入硫酸的作用是防止亚铁离子水解.取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量,故答案为:抑制Fe2+水解,确定氧化Fe2+所需H2O2的量;
(2)依据pH试纸的操作方法分析:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低;故答案为:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;故答案为:温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
(4)水解的原理是Fe2+结合水中的OH-,反应的方程式为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+![]() H2SO4;故答案为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+
H2SO4;故答案为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+![]() H2SO4;
H2SO4;
(5)①酚酞与碱会变红,故达到滴定终点的现象为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;故答案为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
②已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算,w=
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算,w=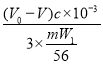 ×100%=
×100%=![]() ×100%;故答案为:
×100%;故答案为:![]() ×100%。
×100%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案