题目内容
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
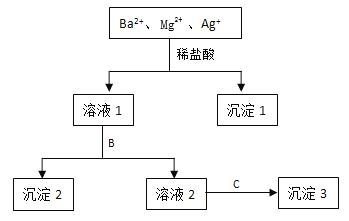
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
【答案】(1)AgCl,Ag++Cl-=AgCl↓;(2)BaSO4;(3)Mg2++2OH-=Mg(OH)2↓;(4)0.5。
【解析】
试题分析:(1)加入稀盐酸,发生Ag++Cl-=AgCl↓,沉淀1为AgCl;(2)溶液1中含有离子是Ba2+、Mg2+、H+和Cl-,加入Na2SO4,发生Ba2++SO42-=BaSO4↓,沉淀2是BaSO4;(3)根据反应(2)的分析,发生反应H++OH-=H2O,Mg2++2OH-=Mg(OH)2↓;(4)根据电荷守恒,2c(Ba2+)+2c(Mg2+)+c(Ag+)=c(NO3-),c(NO3-)=(2×0.1+2×0.1+0.1)mol·L-1=0.5mol·L-1。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目