题目内容
【题目】某研究性学习小组的同学对![]() 、
、![]() 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
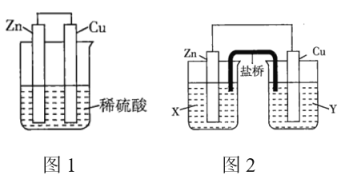
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为_______能。
(2)图2中的X、Y分别是![]() 溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
(3)当图1装置中的溶液质量增加![]() 时,生成氢气_______L(标准状况);当图2中锌电极的质量减少
时,生成氢气_______L(标准状况);当图2中锌电极的质量减少![]() 时,电路中转移的电子为_______
时,电路中转移的电子为_______![]() 。
。
【答案】电 ![]()
![]() 溶液
溶液 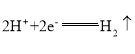 22.4 2
22.4 2
【解析】
(1)该装置为原电池,锌为负极,铜做正极,电子由负极经导线流经正极;
(2)根据反应Zn+H2SO4=ZnSO4+H2原理可知,锌失去的电子经过导线转移到铜片表面,溶液中的H+在铜片上得到电子,放出H2,据此分析;
(3)图1装置中负极1mol锌完全溶解进入溶液中,正极上有1mol氢气析出,因此溶液质量增加63g;图2中当锌电极的质量减少1mol时,根据Zn-2e-=Zn2+可计算出电路中转移电子的量。
(1)锌失去的电子经过导线转移到铜片表面,铜电极上有气泡产生,说明反应中有一部分化学能转化为电能;
(2)锌失去的电子经过导线转移到铜片表面,溶液中的H+在铜片上得到电子,放出H2,则锌浸在![]() 溶液中,铜浸在稀硫酸中;正极极反应为:
溶液中,铜浸在稀硫酸中;正极极反应为: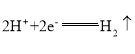 ;
;
(3)当图1装置中的溶液质量增加63g时,溶解的锌为65g,生成的氢气为2g,在标准状况下氢气的体积为![]() ;当图2中锌电极的质量减少
;当图2中锌电极的质量减少![]() 时,即消耗Zn的物质的量为1mol,根据:Zn-2e-=Zn2+可知,电路中转移2mol电子。
时,即消耗Zn的物质的量为1mol,根据:Zn-2e-=Zn2+可知,电路中转移2mol电子。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
【题目】![]() 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
化学式 |
|
| HClO |
电离平衡常数 |
|
|
|
回答下列问题:
(1)一般情况下,当温度升高时,![]() ______填“增大”、“减小”或“不变”。
______填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是______填序号;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______填序号
a. ![]()
b. ![]()
c. ![]()
d. ![]()
(4)用蒸馏水稀释![]() 的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
a. 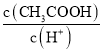 b.
b. ![]() c.
c.![]() d.
d.![]()
(5)体积均为10mLpH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
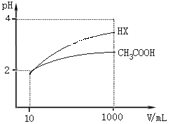
则HX的电离平衡常数______填“大于”、“等于”或“小于”,下同醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+),理由是___________。