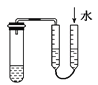
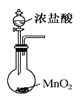
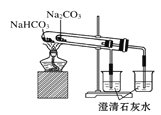
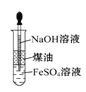
题目内容
【题目】现有常温下![]() 的醋酸和
的醋酸和![]() 的硫酸两种溶液,下列叙述正确的是( )
的硫酸两种溶液,下列叙述正确的是( )
A.两溶液中水电离出的![]() 均为
均为![]()
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的![]() 和硫酸中的
和硫酸中的![]() 相同
相同
D.等体积的两溶液中分别加入足量锌片时放出![]() 的体积相同
的体积相同
【答案】A
【解析】
A.pH=3的醋酸和![]() 的硫酸两种溶液中,酸电离出的氢离子浓度都是
的硫酸两种溶液中,酸电离出的氢离子浓度都是![]() ,常温下离子积常数为
,常温下离子积常数为![]() ,所以两溶液中水电离出的
,所以两溶液中水电离出的![]() 均为
均为![]() ,故A正确;
,故A正确;
B.醋酸存在电离平衡,稀释过程中pH增大程度小,加水稀释100倍后两溶液的pH不相同,硫酸pH增大多,故B错误;
C.根据电荷守恒得![]() ,
,![]() ,pH相对的醋酸和硫酸,氢离子浓度相等,则氢氧根离子浓度相等,所以醋酸根离子浓度是硫酸根离子浓度的2倍,故C错误;
,pH相对的醋酸和硫酸,氢离子浓度相等,则氢氧根离子浓度相等,所以醋酸根离子浓度是硫酸根离子浓度的2倍,故C错误;
D.醋酸是弱酸,![]() 的醋酸和
的醋酸和![]() 的硫酸,醋酸浓度大于硫酸的2倍,等体积两溶液中分别加入足量镁粉后放出
的硫酸,醋酸浓度大于硫酸的2倍,等体积两溶液中分别加入足量镁粉后放出![]() 的体积不相同,醋酸放出氢气多,故D错误;
的体积不相同,醋酸放出氢气多,故D错误;
选A。

 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】分别进行下列操作,由现象得出的结论正确的是![]()
选项 | 操作 | 现象 | 结论 |
A | 滴加 | 生成白色沉淀 | 原溶液中一定有 |
B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是 |
C | 滴加少量稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
D | 将钠放入滴有酚酞的水中 | 溶液变红 | 钠与水反应后的溶液显碱性 |
A.AB.BC.CD.D
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变