��Ŀ����
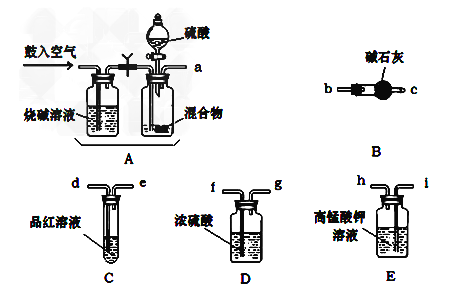
����Ŀ��ijͬѧΪ��֤Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ�������ͼװ�ÿ���֤ͬ����ǽ����Եı仯���ɣ����������ϵ��ʵ�飮 
��1����Na2S��Һ��ͨ���������ֵ���ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��2������A������Ϊ ��
��3����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4 �� ��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽�����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
��4����Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3 �� C�м�Na2SiO3��Һ�۲쵽C����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ�Ӧ����Һ��ȥ��
���𰸡�
��1��S2��+Cl2�TS��+2Cl��
��2����Һ©��
��3��������NaOH
��4���а�ɫ�������ɣ�����NaHCO3
���������⣺��1������������ǿ�����ʣ����������ܹ��������ӷ�Ӧ������Ӧ�����ӷ���ʽΪ��S2��+Cl2�TS��+2Cl�� �� ���Դ��ǣ�S2��+Cl2�TS��+2Cl������2������A������Ϊ��Һ©�������Դ��ǣ���Һ©������3��KMnO4��Ũ���ᷴӦ������������������۵⻯�ػ����Һ��Ӧ���ɵⵥ�ʣ���Ӧ���ӷ���ʽΪ��2I��+Cl2�TI2+2Cl�� �� ����������Һ����ɫ����C����Һ��Ϊ��ɫ����������������ɢ�������У���Ⱦ����������NaOH��Һ���գ���Ӧ���ӷ���ʽΪ��2OH��+Cl2�TCl��+ClO��+H2O�����Դ��ǣ�������NaOH����4����̼��ȹ���ǿ��������̼��������Ʒ�Ӧ���ɹ����������Һ����ǣ��Ȼ�����лӷ��ԣ�����ʵ��������Ҫ��������̼�е��Ȼ�������������Ȼ�����̼�����Ʒ�Ӧ����������̼����Ӧ��������B��C֮������װ�б���NaHCO3��Һ��ϴ��ƿ�����Դ��ǣ��а�ɫ�������ɣ�����NaHCO3 ��