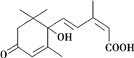
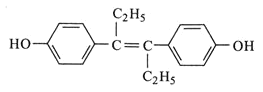
题目内容
【题目】将一定量的铁和铜混合物加入到足量的稀硝酸中,待金属完全溶解![]() 假设反应中还原产物只有
假设反应中还原产物只有![]() 后,向反应后的溶液中加
后,向反应后的溶液中加![]() 溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加
溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加![]() ,下列叙述正确的是
,下列叙述正确的是![]()
![]()
A.上述反应中,转移的电子数为![]()
B.参加反应的金属的总质量![]()
C.当金属全部溶解时,产生的NO气体的体积为![]()
D.当生成的沉淀量达到最大时,消耗NaOH溶液的体积大于300mL
【答案】D
【解析】
将一定量的铁和铜组成的混合物加入到足量稀![]() 中,金属完全溶解
中,金属完全溶解![]() 假设反应中还原产物只有
假设反应中还原产物只有![]() ,发生反应
,发生反应![]() 稀
稀![]() 、
、![]() 稀
稀![]() ;
;
向反应后的溶液中加入过量的![]() NaOH溶液至沉淀完全,发生反应:
NaOH溶液至沉淀完全,发生反应:![]() 、
、![]() ,沉淀为氢氧化铁和氢氧化铜,生成沉淀的质量比原合金的质量增加
,沉淀为氢氧化铁和氢氧化铜,生成沉淀的质量比原合金的质量增加![]() ,则氢氧化铁和氢氧化铜含有氢氧根的质量为
,则氢氧化铁和氢氧化铜含有氢氧根的质量为![]() ,氢氧根离子的物质的量为:
,氢氧根离子的物质的量为:![]() ,以此解答该题。
,以此解答该题。
将一定量的铁和铜组成的混合物加入到足量稀![]() 中,金属完全溶解
中,金属完全溶解![]() 假设反应中还原产物只有
假设反应中还原产物只有![]() ,发生反应
,发生反应![]() 稀
稀![]() 、
、![]() 稀
稀![]() ;向反应后的溶液中加入过量的
;向反应后的溶液中加入过量的![]() NaOH溶液至沉淀完全,发生反应:
NaOH溶液至沉淀完全,发生反应:![]() 、
、![]() ,沉淀为氢氧化铁和氢氧化铜,生成沉淀的质量比原合金的质量增加
,沉淀为氢氧化铁和氢氧化铜,生成沉淀的质量比原合金的质量增加![]() ,则氢氧化铁和氢氧化铜含有氢氧根的质量为
,则氢氧化铁和氢氧化铜含有氢氧根的质量为![]() ,氢氧根离子的物质的量为:
,氢氧根离子的物质的量为:![]() ,故A错误;
,故A错误;
B、转移电子的物质的量为![]() ,如全部为铁,则金属的质量为
,如全部为铁,则金属的质量为![]() ,如全部为铜,则金属的质量为
,如全部为铜,则金属的质量为![]() ,则参加反应的金属的总质量为
,则参加反应的金属的总质量为![]() ,故B错误;
,故B错误;
C、转移![]() 电子,则生成
电子,则生成![]() ,但气体存在的条件未知,不能确定体积大小,故C错误;
,但气体存在的条件未知,不能确定体积大小,故C错误;
D、形成沉淀消耗![]() ,硝酸有剩余,氢氧化钠要先中和硝酸,氢氧化钠浓度为
,硝酸有剩余,氢氧化钠要先中和硝酸,氢氧化钠浓度为![]() ,则消耗NaOH溶液的体积大于300mL,故D正确。
,则消耗NaOH溶液的体积大于300mL,故D正确。
答案选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C与B同周期且基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色;且D、G的原子序数相差10;E元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为___。
(2)与BC分子互为等电子体的离子为___ (填化学式,任写一种)。
(3)在液态非极性分子B6A6中,B原子采取的杂化方式为___。
(4)元素C的简单氢化物的沸点比同主族的简单氢化物都高的原因是___。
(5)F可形成化学式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
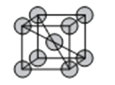
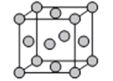
(6)金属D、G晶体的晶胞结构如图所示。
①金属G的晶胞中,测得晶胞中G原子的半径为apm,则G晶体的密度为___g/cm3(列出表达式即可,NA为阿伏伽德罗常数的值),D、G两种晶胞中金属的配位数之比为___。
②金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能(I2),其主要原因是___。