题目内容
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
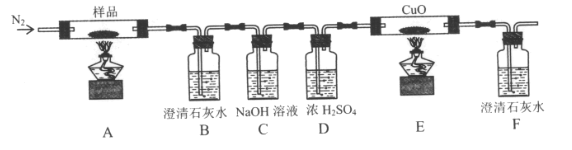
①通入氮气的目的是_________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有_______,____。
③样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:____。
【答案】3 2 1 3K2C2O4 隔绝空气,使反应产生的气体全部进入后续装置 CO2 CO 取少许固体粉末于试管中,加稀硫酸溶解,滴入1-2滴KSCN溶液,溶液变红色,证明含有Fe2O3
【解析】
(1)显色过程是Fe2+和[Fe(CN)6]3-结合成蓝色沉淀的反应,化学方程式为:3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2+3K2C2O4,故答案为:3,2,1,3K2C2O4。
(2)①通入氮气的目的是隔绝空气、使反应产生的气体全部进入后续装置,从而保证实验的准确性,故答案为隔绝空气,使反应产生的气体全部进入后续装置。
②B中澄清石灰水变浑浊证明一定有CO2,E中固体变红、F中澄清石灰水变浑浊证明分解产物中有CO,故答案为:CO2,CO。
③检验固体中是否存在Fe2O3,需要使用硫酸溶解Fe2O3,将其转化成Fe3+,再用KSCN进行检验,若溶液变红色,证明含有Fe2O3,故答案为:取少许固体粉末于试管中,加稀硫酸溶解,滴入1-2滴KSCN溶液,溶液变红色,证明含有Fe2O3。

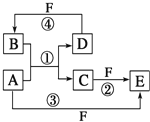
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
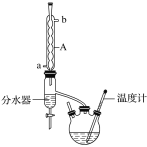
【题目】丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
相对分子质量 | 密度(g·cm-3) | 沸点(℃) | 水中溶解性 | |
正丁酸 | 88 | 0.958 7 | 163.5 | 溶 |
异戊醇 | 88 | 0.813 2 | 131 | 微溶 |
丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇、0.1 mol正丁酸、数滴浓硫酸、5 mL苯和2~3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g。
回答下列问题:
(1)图中A仪器的名称是___________。
(2)在该实验中,三颈烧瓶的容积最适合的是_____(填字母)。
A.50mL B.100mL C.200mL
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)分离提纯过程中加入无水硫酸镁的目的是______________。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是_______(填字母)。

(6)本实验的产率是______(保留三位有效数字)。