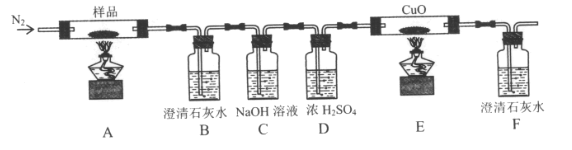
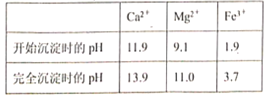
题目内容
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
(1)C60、金刚石和石墨三者的关系是互为_____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于_____(填“原子”或“分子”)晶体。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有硅﹣硅单键的数目约是_____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是_____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有_____个与之紧邻且等距的CO2分子;该结构单元平均占有_____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为_____,每个Cs+配位数为_____。
【答案】B 分子 2 2 12 4 6 8
【解析】
(1)同种元素的不同单质互称同素异形体;
(2)根据晶体构成微粒判断晶体类型;
(3)每个硅原子含有2个硅硅键;
(4)利用均摊法计算;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;
(6)根据CsCl晶体的晶胞分析。
(1)同种元素的不同单质互称同素异形体,C60、金刚石和石墨是碳元素的不同单质,属于同素异形体;故答案为:B。
(2)C60中构成微粒是分子,所以属于分子晶体,故答案为:分子。
(3)每个硅原子含有2个硅硅键,则1mol硅晶体中含有硅硅单键的数目约是2NA个,故答案为:2。
(4)石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×![]() =2,故答案为:2。
=2,故答案为:2。
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;晶胞中分子数目=8×![]() +6×
+6×![]() =4;故答案为:12;4。
=4;故答案为:12;4。
(6)以大立方体体心的Cs+为例,与其距离相等且距离最近的Cs+位于大立方体的六个面心,所以每个Cs+周围与它最近且距离为a的的Cs+共有3×8×![]() =6个;每个Cs+周围紧邻且等距的Cl-数目=1×8=8,所以每个Cs+配位数为8,故答案为:6;8。
=6个;每个Cs+周围紧邻且等距的Cl-数目=1×8=8,所以每个Cs+配位数为8,故答案为:6;8。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案