题目内容
16.下列异构属于何种异构(官能团异构;碳链异构;官能团位置异构)①1-丙醇和 2-丙醇官能团位置异构;
②CH3COOH 和 HCOOCH3官能团异构;
③CH3CH2CHO 和 CH3COCH3官能团异构;
④(CH3)3CH和 CH3CH2CH2CH3碳链异构;
⑤CH3CH=CHCH2CH2CH3 和 CH3CH2CH=CHCH2CH3官能团位置异构.
分析 ①碳链异构:相同碳原子,形成不同的骨架; ②位置异构还是同样的官能团(不过连的位置不同);
③组成相同而分子中的各种原子结合方式或顺序不同,因此有不同的官能团,这些化合物叫官能团异构,据此解答即可.
解答 解:(1)①1-丙醇和 2-丙醇含同样的官能团(不过连的位置不同)故属于官能团位置异构;
②CH3COOH 和 HCOOCH3含有的官能团不同,属于官能团异构;
③CH3CH2CHO 和 CH3COCH3含有的官能团不同,属于官能团异构;
④(CH3)3CH和 CH3CH2CH2CH3碳架结构不同,属于碳链异构;
⑤CH3CH=CHCH2CH2CH3 和 CH3CH2CH=CHCH2CH3含同样的官能团(不过连的位置不同)故属于官能团位置异构;
故答案为:官能团位置异构;官能团异构;官能团异构;碳链异构;官能团位置异构.
点评 本题主要考查了有机物结构以及同分异构体的不同类型,熟练掌握各种异构关系是解决本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.原子序数依次递增的4种短周期元素可形成简单离子 W2-,X+,Y3+,Z2-,下列说法不正确的是( )
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:W2->X+>Y3+>Z2-? | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
11.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.
下表是一些键能数据(KJ•mol-1):
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
8.钾的还原性比钠强,原因是( )
| A. | K的相对原子质量比较大 | |
| B. | K可失的电子数较多 | |
| C. | K含有的电子数较多 | |
| D. | K和Na最外层电子数相同,但钾原子的半径较大 |
5.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 乙烯的结构简式 C2H4 | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型 |
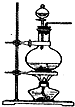 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.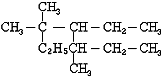 完成下列小题
完成下列小题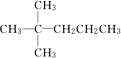 ,
,