题目内容
8.钾的还原性比钠强,原因是( )| A. | K的相对原子质量比较大 | |
| B. | K可失的电子数较多 | |
| C. | K含有的电子数较多 | |
| D. | K和Na最外层电子数相同,但钾原子的半径较大 |
分析 同主族元素随原子序数的递增,原子半径逐渐增大,原子对最外层电子的吸引能力减弱,则失电子能力增强,金属性增强,单质的还原性增强.
解答 解:同主族元素随原子序数的递增,原子半径逐渐增大,原子对最外层电子的吸引能力减弱,则失电子能力增强,金属性增强,单质的还原性增强,已知钾的原子序数比钠的大,则半径K大于Na,所以金属性K大于Na,即钾的还原性比钠强,
故选D.
点评 本题考查了同主族元素性质存在递变规律的原因,主要从原子结构的角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.已知M、N、R均为短周期的元素,M、N同周期,M、R的最低价离子分别为M2-和R-,N2+和R-具有相同的电子层结构,下列说法正确的是( )
| A. | 对应气态氢化物的稳定性M>R | B. | R元素的最高正价一定为+7价 | ||
| C. | 离子半径:M2->R->N2+ | D. | 还原性:M2-<R- |
19.某单烯烃与氢气加成以后的产物是(CH3)2CHCH(CH3)C(CH3)3,该烯烃可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
13.下列物质属于烃的是( )
| A. | C2H5Br | B. | C2H6 | C. | C2H5OH | D. | CH3COOH |
17.向下列各溶液中通入CO2直到过量,未反生“先产生沉淀,然后沉淀又溶解”这一现象的是( )
①饱和碳酸钠溶液②漂白粉溶液③氯化钙溶液④硅酸钠溶液.
①饱和碳酸钠溶液②漂白粉溶液③氯化钙溶液④硅酸钠溶液.
| A. | ①③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
7.下列关于氯水的叙述,正确的是( )
| A. | 氯水中只含Cl2和HClO两种分子 | |
| B. | 新制氯水只能使蓝色石蕊试纸变红 | |
| C. | 光照氯水有气泡逸出,该气体主要是Cl2 | |
| D. | 氯水放置数天后其pH将变小,酸性增强 |
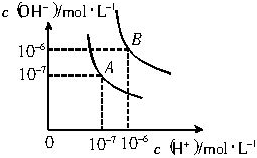 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.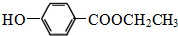
 .
.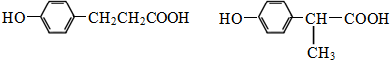 .
.