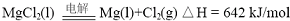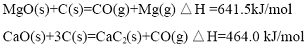题目内容
(2012?江苏一模)下列装置图或曲线图与对应的叙述相符的是( )

分析:图1:为原电池反应,Fe为正极,Zn为负极;
图2:浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性;
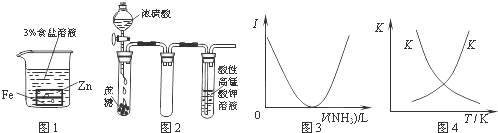
图3:乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质;
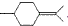
图4:温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大.
图2:浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性;
图3:乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质;
图4:温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大.
解答:解:A.Zn较活泼,应为原电池的负极,负极反应是Zn-2e-=Zn2+,故A错误;
B.浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性,二氧化碳微溶于水,溶液中有气泡,故B错误;
C.乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质,溶液导电性增强,故C错误;
D.温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大,故D正确.
故选D.
B.浓硫酸和蔗糖反应生成二氧化碳和二氧化硫气体,二氧化硫具有还原性,二氧化碳微溶于水,溶液中有气泡,故B错误;
C.乙酸为弱电解质,与氨气反应生成醋酸铵,为强电解质,溶液导电性增强,故C错误;
D.温度升高,平衡向逆方向移动,正反应平衡常数减小,逆反应平衡常数增大,故D正确.
故选D.
点评:本题较为综合,侧重于原电池反应、元素混合物知识、电解质以及化学平衡等问题的考查,题目难度中等,注意把握平衡常数的意义.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目


 ,则异蒲勒醇的结构简式为
,则异蒲勒醇的结构简式为
 的合成路线流程图.(无机试剂任用,合成路线流程图示例如下:
的合成路线流程图.(无机试剂任用,合成路线流程图示例如下: )
)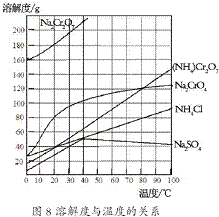 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: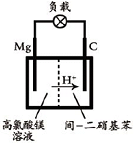 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有: