题目内容
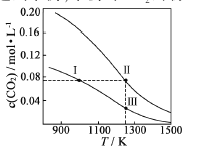
【题目】在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是()
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是()
A. 反应CO2(g)+c(s)![]() 2CO(g)△S>0、△H<0
2CO(g)△S>0、△H<0
B. 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
【答案】BC
【解析】A.C和CO2反应是吸热反应,△H>0,故A错误;
B.曲线Ⅰ,是通入0.1molCO2, 曲线Ⅱ是通入0.2molCO2,状态Ⅱ可以看作先通0.1molCO2,此时的压强相等,再通入0.1molCO2加入平衡不 移动,此时的压强等于2倍P总(状态Ⅰ),但要求CO2的浓度相等,应对此加热使反应向正反应方向移动, 气体物质的量增加,因此P总(状态Ⅱ)>2P总(状态Ⅰ),故正确;
C.状态Ⅱ可以看作先通0.1molCO2,此时 两者CO的浓度相等,再通入0.1molCO2,如果平衡不移动,Ⅱ状态CO的浓度等于2倍Ⅲ,但再充入CO2,相当增大压强,平衡右移,消耗CO,因此c(CO,状态Ⅱ)<2c(CO,状态Ⅲ),故正确;
D.温度越高,反应 速率越快,V逆(状态Ⅰ)逆(状态Ⅲ),故D错误。

练习册系列答案
相关题目