题目内容
【题目】A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素,A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素既不同周期,也不同主族,请回答:
(1)C元素在元素周期表中的位置是;
(2)A、B、D可组成一种离子化合物,是常见的化肥,其化学式为;
(3)A2和D2两种物质可以构成一种新型的原电池,若原电池中电解质溶液为KOH溶液,则正极的电极反应式为;
(4)若将一充满20mLBA2和A2混合气体的大试管倒立于D2A中,充分反应后,在相同条件下,测得试管中余下5mL无色气体,则原混合气体中BA2和A2物质的量之比为 .
【答案】
(1)第三周期第ⅥA族
(2)NH4NO3
(3)O2+2H2O+4e﹣=4OH﹣
(4)3:2或9:1
【解析】解:A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31,则A、B、C可能有如下几种相对位置: 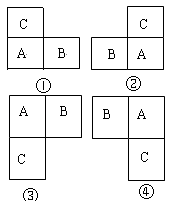
①设A的原子序数为x,则C为x﹣8,B为x+1,则x+x﹣8+x+1=31,解之得:x= ![]() ,不符合题意;②设A的原子序数为x,则C为x﹣8,B为x﹣1,则x+x﹣8+x﹣1=31,解之得:x=
,不符合题意;②设A的原子序数为x,则C为x﹣8,B为x﹣1,则x+x﹣8+x﹣1=31,解之得:x= ![]() ,不符合题意;③设A的原子序数为x,则C为x+8,B为x+1,则x+x+8+x+1=31,解之得:x=
,不符合题意;③设A的原子序数为x,则C为x+8,B为x+1,则x+x+8+x+1=31,解之得:x= ![]() ,不符合题意;④设A的原子序数为x,则C为x+8,B为x﹣1,则x+x+8+x﹣1=31,解之得:x=8,则A为O元素,B为N元素,C为S元素,D元素与A、B、C三种元素既不是同周期,也不同主族,且为短周期元素,应为H元素,(1)C为S元素,原子核外有3个电子层,最外层电子为6,位于周期表中第三周期第ⅥA族,所以答案是:第三周期第ⅥA族;(2)O、N、H可组成离子化合物,是一种常见的速效化肥,其化学式为:NH4NO3 , 所以答案是:NH4NO3;(3)O2和H2两种物质可以构成一种新型的原电池,若原电池中电解质溶液为KOH溶液,氢气与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e﹣=4OH﹣ , 负极的电极方程式为:2H2+4OH﹣=4H2O+4e﹣ , 所以答案是:O2+2H2O+4e﹣=4OH﹣;(4)若将一充满20mL NO2和O2混合气体的大试管倒立于H2O中,充分反应后,在相同条件下,测得试管中余下5mL无色气体,二氧化氮和氧气和水反应方程式为4NO2+O2+2H2O=4HNO3 , 剩余气体可能是O2 , 也可能是NO,
,不符合题意;④设A的原子序数为x,则C为x+8,B为x﹣1,则x+x+8+x﹣1=31,解之得:x=8,则A为O元素,B为N元素,C为S元素,D元素与A、B、C三种元素既不是同周期,也不同主族,且为短周期元素,应为H元素,(1)C为S元素,原子核外有3个电子层,最外层电子为6,位于周期表中第三周期第ⅥA族,所以答案是:第三周期第ⅥA族;(2)O、N、H可组成离子化合物,是一种常见的速效化肥,其化学式为:NH4NO3 , 所以答案是:NH4NO3;(3)O2和H2两种物质可以构成一种新型的原电池,若原电池中电解质溶液为KOH溶液,氢气与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e﹣=4OH﹣ , 负极的电极方程式为:2H2+4OH﹣=4H2O+4e﹣ , 所以答案是:O2+2H2O+4e﹣=4OH﹣;(4)若将一充满20mL NO2和O2混合气体的大试管倒立于H2O中,充分反应后,在相同条件下,测得试管中余下5mL无色气体,二氧化氮和氧气和水反应方程式为4NO2+O2+2H2O=4HNO3 , 剩余气体可能是O2 , 也可能是NO,
当剩余气体是O2时,根据方程式知,二氧化氮的体积= ![]() ×4=12mL,原混合气体中氧气的体积为:20mL﹣12mL=8mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=12mL:8mL=3:2;
×4=12mL,原混合气体中氧气的体积为:20mL﹣12mL=8mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=12mL:8mL=3:2;
当剩余气体是NO时,根据3NO2+H2O=2HNO3+NO知,与水反应的二氧化氮体积为一氧化氮的2倍,为5mL×2=10mL,再结合4NO2+O2+2H2O=4HNO3知,混合气体中
氧气的体积为: ![]() ×1=2mL,原混合气体中NO2的体积为:20mL﹣2mL=18mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=18mL:2mL=9:1,
×1=2mL,原混合气体中NO2的体积为:20mL﹣2mL=18mL,相同条件下物质的量之比等于气体体积之比,则原混合气体中NO2和O2物质的量之比=18mL:2mL=9:1,
所以答案是:3:2 或 9:1.

【题目】根据表(部分短周期元家的原子半径及主要化合价)信息,完成有关问题:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、﹣2 | ﹣2 |
(1)A、B、D、E的简单离子半径由大到小的顺序是(用具体离子符号表示);
(2)B单质和C单质的化学性质相似,试写出C单质与强碱溶液反应的离子方程式;
(3)D和E组成的两种化合物中具有漂白性的是 , 该化合物转化为另一种化合物的化学方程式为;
(4)已知A的氢化物能与水反应生成一种可燃性气体和一种强碱,试写出该反应的化学方程式 .