题目内容
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是
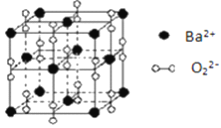
A. 与每个Ba2+距离相等且最近的Ba2+共有6个 B. 晶体中Ba2+的配位数为8
C. 晶体的化学式为Ba2O2 D. 该化合物是含有非极性键的离子化合物
【答案】D
【解析】晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8×![]() +6×
+6×![]() =4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×
=4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×![]() +1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2。A.与每个Ba2+距离相等且最近的Ba2+为顶点和面心位置,每个晶胞中含有3×
+1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2。A.与每个Ba2+距离相等且最近的Ba2+为顶点和面心位置,每个晶胞中含有3×![]() 个,每个顶点为8个晶胞共有,则共有8×3×
个,每个顶点为8个晶胞共有,则共有8×3×![]() =12个,故A错误;B.晶体中位于顶点的Ba2+离子和位于边上的阴离子距离最近,每个顶点为8个晶胞所共有,而每个边为4个晶胞共有,每个晶胞中有3个边上的阴离子距离相等且最近,根据均摊法计算,晶体中每个Ba2+同时吸引着阴离子的数目为8×3×
=12个,故A错误;B.晶体中位于顶点的Ba2+离子和位于边上的阴离子距离最近,每个顶点为8个晶胞所共有,而每个边为4个晶胞共有,每个晶胞中有3个边上的阴离子距离相等且最近,根据均摊法计算,晶体中每个Ba2+同时吸引着阴离子的数目为8×3×![]() =6,故B错误;C.由以上分析可知晶体的化学式为BaO2,故C错误;D.该物质为活泼金属和活泼非金属形成的化合物,应为离子化合物,含有O-O,为非极性键,为含有非极性键的离子化合物,故D正确;故选D。
=6,故B错误;C.由以上分析可知晶体的化学式为BaO2,故C错误;D.该物质为活泼金属和活泼非金属形成的化合物,应为离子化合物,含有O-O,为非极性键,为含有非极性键的离子化合物,故D正确;故选D。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目