题目内容
【题目】在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:
A(g)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A. 反应前2 min的平均速率v(C)=0.004 mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v (逆)> v (正)
C. 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol
D. 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大
【答案】D
【解析】
试题前2 min的平均速率v(B)=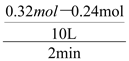 ="0.004" mol/(L·min),则v(C)=0.008 mol/(L·min),A错误;降低温度,平衡向右移动,达到新平衡前v (逆)<v (正),B错误;起始时向容器中充入0.64mol A和0.64mol B,相当于加压,使体积变成原来的一半,而加压时平衡不移动,但个物质的物质的量会变成原来的2倍,原平衡时n(B)=0.2mol,则n(C)=2×(0.32mol—0.2mol)=0.24mol,因此新平衡时n(C)=0.48mol,C错误;向平衡体系中再充入0.32mol A,平衡向右移动,B的转化率增大,D正确。
="0.004" mol/(L·min),则v(C)=0.008 mol/(L·min),A错误;降低温度,平衡向右移动,达到新平衡前v (逆)<v (正),B错误;起始时向容器中充入0.64mol A和0.64mol B,相当于加压,使体积变成原来的一半,而加压时平衡不移动,但个物质的物质的量会变成原来的2倍,原平衡时n(B)=0.2mol,则n(C)=2×(0.32mol—0.2mol)=0.24mol,因此新平衡时n(C)=0.48mol,C错误;向平衡体系中再充入0.32mol A,平衡向右移动,B的转化率增大,D正确。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目