题目内容
【题目】如图是组成生物体的部分高分子化合物与组成它们的化学元素的关系图:
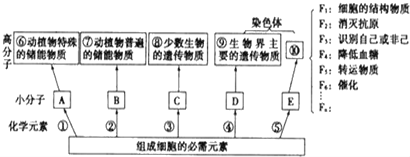
(1)构成小分子A、B、C、D、E的化学元素中,相同的元素有_____.
(2)写出下列高分子的名称:⑦___;⑨_____;⑩ _________.
(3)导致F1~Fn差别的原因是____________________________________.
(4)小分子C和D比较一定不同的是,前者含________,后者含______.
(5)写出下列物质的具体名称:F2为______;F6 为________.
【答案】C、H、O 脂肪 DNA 蛋白质 构成多肽的氨基酸种类、数量和排列顺序不同,蛋白质的空间结构不同 核糖 脱氧核糖 抗体 酶
【解析】
根据图示中各物质功能可推测图示中小分子物质:A是葡萄糖,B是脂肪酸和甘油,C是核糖核苷酸,D是脱氧核苷酸,E是氨基酸。糖类的组成元素为C、H、O,脂肪的组成元素也是C、H、O,核苷酸的组成元素为C、H、O、N、P,氨基酸的组成元素为C、H、O、N,有的还含有S、P。
(1)根据分析可知,A是葡萄糖,B是脂肪酸和甘油,C是核糖核苷酸,D是脱氧核苷酸,E是氨基酸,它们均含有的元素为C、H、O。
(2)动植物体中普遍存在的储能物质为脂肪,故⑦为脂肪。生物界主要的遗传物质是DNA,故⑨是DNA。染色体的主要组成成分是DNA和蛋白质,⑨是DNA,故⑩是蛋白质。
(3)蛋白质的结构多样性决定功能多样性,构成蛋白质结构多样性的原因有:构成多肽的氨基酸种类、数量和排列顺序不同,蛋白质的空间结构不同。
(4)小分子物质C是核糖核苷酸,D是脱氧核苷酸,组成二者的五碳糖中前者是核糖,后者是脱氧核糖。另外核糖核苷酸特有的碱基为U,脱氧核苷酸特有的碱基为T,另外二者还具有共同的三种碱基G、C、A。
(5)具有免疫功能,能消灭抗原的是抗体,故F2为抗体;具有催化作用的蛋白质是酶,故F6为酶。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

【题目】沉淀溶解平衡在生产、科研和环保等领域有着许多应用。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,通过计算确定应调节溶液的pH范围是______。(已知lg5=0.7)
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol·L-1 AgNO3溶液 | 现象a,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变为红色的离子方程式:____________________。
②步骤3中现象a是____________________________。
③用化学平衡原理解释步骤4中的实验现象:_________________________________。