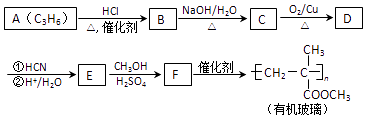
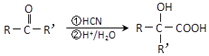
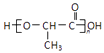ĢāÄæÄŚČŻ
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌŖĖŲA”¢B”¢C”¢DŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬B”¢D×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ12£¬¶žÕßæÉŠĪ³ÉDB2”¢DB3Į½ÖÖ·Ö×Ó£¬DB2¾ßÓŠĘư׊Ō£®
A | B | |
C | D |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AĪ»ÓŚŌŖĖŲÖÜĘŚ±ķÖÜĘŚ£¬×壬ĘäĒā»ÆĪļµÄ·Ö×ÓŹ½ŹĒ £®
£Ø2£©ĻĀĮŠŠšŹöÖŠ£¬ÕżČ·µÄŹĒ£ØĢī×ÖÄø£©£®
a£®ĪČ¶ØŠŌ£ŗAµÄĒā»ÆĪļ£¾CµÄĒā»ÆĪļ b£®»¹ŌŠŌ£ŗB2©£¾D2©
c£®ĖįŠŌ£ŗH4CO4£¾H2DO4 d£®×īøß»ÆŗĻ¼ŪÖµ£ŗD=B£¾A£¾C
£Ø3£©DB2ĶعżĻĀĮŠ¹¤ŅÕĮ÷³ĢæÉÖĘ»Æ¹¤ŅµŌĮĻH2DB4ŗĶĒå½ąÄÜŌ“H2 £® 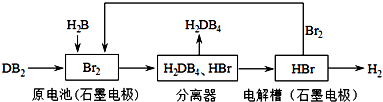
¢ŁŌµē³ŲÖŠDB2²ĪÓė·“Ó¦µÄµē¼«ĪŖ £¬ Š“³öµē¼«·“Ó¦Ź½£»ČōÓŠ5mol DB2²Ī¼Ó·“Ó¦£Ø¼ŁČō·“Ó¦ĪļĪŽĖšŗÄ£©£¬ŌņÉś³É±ź×¼×“æöĻĀL H2 £®
¢ŚĪŖ¼ģŃé·ÖĄėĘ÷µÄ·ÖĄėŠ§¹ū£¬Č”·ÖĄėŗóµÄH2DB4ČÜŅŗÓŚŹŌ¹Ü£¬ĻņĘäÖŠÖšµĪ¼ÓČėAgNO3ČÜŅŗÖĮ³ä·Ö·“Ó¦£¬Čō¹Ū²ģµ½ £¬ Ö¤Ć÷·ÖĄėŠ§¹ū½ĻŗĆ£®
¢Ū½«øĆ¹¤ŅÕĮ÷³ĢÓĆ×Ü·“Ó¦µÄ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ£ŗ
”¾“š°ø”æ
£Ø1£©¶ž£»VA£»NH3
£Ø2£©a
£Ø3£©øŗ¼«£»SO2+2H2O©2e©=4H++SO42©£»112£»ĪŽµ»ĘÉ«³Įµķ²śÉś£¬×īÖÕÉś³É°×É«³Įµķ£»SO2+2H2O=H2SO4+H2
”¾½āĪö”æ½ā£ŗÓɶĢÖÜĘŚŌŖĖŲA”¢B”¢C”¢DŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆæÉÖŖ£¬A”¢B“¦ÓŚµŚ¶žÖÜĘŚ£¬C”¢D“¦ÓŚµŚČżÖÜĘŚ£¬B”¢DĶ¬ÖÖÖ÷×壬B”¢D×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ12£¬¹Ź×īĶā²ćµē×ÓŹżĪŖ6£¬¹ŹBĪŖOŌŖĖŲ£¬DĪŖSŌŖĖŲ£¬¶žÕßæÉŅŌŠĪ³ÉSO2”¢SO3Į½ÖÖ·Ö×Ó£¬ĒŅSO2¾ßÓŠĘư׊Ō£¬ÓÉĪ»ÖĆ¹ŲĻµæÉÖŖ£¬AĪŖNŌŖĖŲ£¬CĪŖSiŌŖĖŲ£¬£Ø1£©AĪŖNŌŖĖŲ£¬“¦ÓŚµŚ¶žÖÜĘŚVA×壬ĘäĒā»ÆĪļĪŖNH3 £¬ ĖłŅŌ“š°øŹĒ£ŗ¶ž”¢VA£»NH3£»£Ø2£©a£®·Ē½šŹōŠŌN£¾Si£¬¹ŹĒā»ÆĪļĪČ¶ØŠŌNH3£¾SiH4 £¬ ¹ŹaÕżČ·£»b£®·Ē½šŹōŠŌO£¾S£¬·Ē½šŹōŠŌŌ½Ē棬ŅõĄė×ӵĻ¹ŌŠŌŌ½Čõ£¬¹Ź»¹ŌŠŌO2©£¼S2© £¬ ¹Źb“ķĪó£»
C£®·Ē½šŹōŠŌS£¾Si£¬¹ŹĖįŠŌ£ŗH4SiO4£¼H2SO4 £¬ ¹Źc“ķĪó£»
d£®ŃõŌŖĖŲŅ»°ćĆ»ÓŠÕż»ÆŗĻ¼Ū£¬¹Źd“ķĪó£»
ĖłŅŌ“š°øŹĒ£ŗa£»£Ø3£©Óɹ¤ŅÕĮ÷³ĢĶ¼æÉÖŖ£¬Ōµē³ŲŌĄķĪŖSO2+Br2+2H2O=H2SO4+2HBr£¬·ÖĄė³öĮņĖį£¬ŌŁµē½ā£ŗ2HBr ![]() H2”ü+Br2 £¬ »ńµĆĒāĘų£¬µē½āµĆµ½µÄäåŃ»·ĄūÓĆ£®
H2”ü+Br2 £¬ »ńµĆĒāĘų£¬µē½āµĆµ½µÄäåŃ»·ĄūÓĆ£®
¢ŁŌŚŌµē³ŲÖŠ£¬øŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬SO2ŌŚøŗ¼«·ÅµēÉś³ÉH2SO4 £¬ µē¼«·“Ó¦Ź½ĪŖSO2+2H2O©2e©=4H++SO42© £¬ øł¾ŻSO2+Br2+2H2O=H2SO4+2HBr”¢2HBr ![]() H2”ü+Br2æÉµĆ¹ŲĻµŹ½£ŗSO2”«H2 £¬ ČōÓŠ5mol SO2²Ī¼Ó·“Ó¦£Ø¼ŁČō·“Ó¦ĪļĪŽĖšŗÄ£©£¬ŌņÉś³É±ź×¼×“æöĻĀH2Ģå»żĪŖ5mol”Į22.4L/mol=112L£¬
H2”ü+Br2æÉµĆ¹ŲĻµŹ½£ŗSO2”«H2 £¬ ČōÓŠ5mol SO2²Ī¼Ó·“Ó¦£Ø¼ŁČō·“Ó¦ĪļĪŽĖšŗÄ£©£¬ŌņÉś³É±ź×¼×“æöĻĀH2Ģå»żĪŖ5mol”Į22.4L/mol=112L£¬
ĖłŅŌ“š°øŹĒ£ŗøŗ¼«£»SO2+2H2O©2e©=4H++SO42©£»112£»
¢Ś·ÖĄėŗóµÄH2SO4ČÜŅŗÓŚŹŌ¹Ü£¬ĻņĘäÖŠÖšµĪ¼ÓČėAgNO3ČÜŅŗÖĮ³ä·Ö·“Ó¦£¬Čō¹Ū²ģµ½ĪŽµ»ĘÉ«³Įµķ²śÉś£¬×īÖÕÉś³É°×É«³Įµķ£¬ĖµĆ÷·ÖĄėŠ§¹ū½ĻŗĆ£¬ĖłŅŌ“š°øŹĒ£ŗĪŽµ»ĘÉ«³Įµķ²śÉś£¬×īÖÕÉś³É°×É«³Įµķ£»
¢ŪŌµē³ŲÖŠµē³Ų×Ü·“Ó¦ĪŖSO2+Br2+2H2O=H2SO4+2HBr£¬µē½ā³ŲÖŠ×Ü·“Ó¦ĪŖ2HBr=H2+Br2 £¬ ¹ŹøĆ¹¤ŅÕĮ÷³ĢÓĆ×Ü·“Ó¦µÄ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ£ŗSO2+2H2O=H2SO4+H2 £¬
ĖłŅŌ“š°øŹĒ£ŗSO2+2H2O=H2SO4+H2 £®

”¾ĢāÄæ”æŹŌ»Ų“šĻĀĮŠø÷Ģā£ŗ 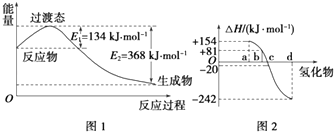
£Ø1£©ČēĶ¼1ĖłŹ¾ŹĒNO2ŗĶCO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³öNO2ŗĶCO·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ
£Ø2£©»Æѧ·“Ó¦µÄģŹ±äÓė·“Ó¦ĪļŗĶÉś³ÉĪļµÄ¼üÄÜÓŠ¹Ų£®
¢ŁŅŃÖŖ£ŗH2£Øg£©+Cl2£Øg£©ØT2HCl£Øg£©”÷H=©185kJmol©1
ĒėĢīæÕ£ŗ
¹²¼Ū¼ü | H©H | Cl©Cl | H©Cl |
¼üÄÜ/£ØkJmol©1£© | 436 | 247 |
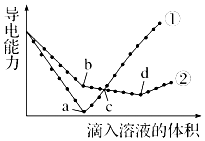
¢ŚĶ¼2ÖŠ±ķŹ¾Ńõ×åŌŖĖŲÖŠŃõ”¢Įņ”¢Īų”¢ķŚÉś³ÉĒā»ÆĪļŹ±µÄģŹ±äŹż¾Ż£¬øł¾ŻģŹ±äŹż¾ŻæÉČ·¶Øa”¢b”¢c”¢d·Ö±š“ś±ķÄÄÖÖŌŖĖŲ£¬ŹŌŠ“³öĪų»ÆĒāŌŚČČĮ¦Ń§±ź×¼×“Ģ¬ĻĀ£¬·¢Éś·Ö½ā·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ £®
£Ø3£©ŅŃÖŖ£ŗFe2O3£Øs£©+3CO£Øg£©ØT2Fe£Øs£©+3CO2£Øg£©”÷H=©25kJmol©1¢Ł
3Fe2O3£Øs£©+CO£Øg£©ØT2Fe3O4£Øs£©+CO2£Øg£©”÷H=©47kJmol©1¢Ś
Fe3O4£Øs£©+CO£Øg£©ØT3FeO£Øs£©+CO2£Øg£©”÷H=+19kJmol©1¢Ū
ĒėŠ“³öCO»¹ŌFeOµÄČČ»Æѧ·½³ĢŹ½£ŗ
”¾ĢāÄæ”æ»·¾³ĪŪČ¾ŅŃ³ÉĪŖČĖĄąÉē»įĆęĮŁµÄÖŲ“óĶžŠ²£¬ĻĀĮŠ¶ŌÓ¦¹ŲĻµ²»ÕżČ·µÄŹĒ
»·¾³ĪŹĢā | Ö÷ŅŖĪŪČ¾Īļ | »·¾³ĪŹĢā | Ö÷ŅŖĪŪČ¾Īļ | ||
A | ĖįÓź | ¶žŃõ»ÆĮņ | C | °×É«ĪŪČ¾ | ¶žŃõ»Æ¹č |
B | ĪĀŹŅŠ§Ó¦ | ¶žŃõ»ÆĢ¼ | D | ¹ā»ÆѧŃĢĪķ | ¶žŃõ»ÆµŖ |
A. AB. BC. CD. D