题目内容
7.下列设计的实验方案能达到实验目的是( )| A. | 通过灼热的镁粉除去N2中的O2 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液 |
分析 A.Mg与氮气、氧气均反应;
B.Br2(g)和NO2均可氧化KI;
C.向沸水中滴加饱和FeCl3溶液,水解可制备胶体;
D.先加盐酸排除干扰离子,再加氯化钡生成白色沉淀为硫酸钡.
解答 解:A.Mg与氮气、氧气均反应,则应利用灼热的铜粉除去N2中的O2,故A错误;
B.Br2(g)和NO2均可氧化KI,现象相同,不能鉴别,故B错误;
C.向沸水中滴加饱和FeCl3溶液,水解可制备Fe(OH)3胶体,故C正确;
D.先加盐酸排除干扰离子,再加氯化钡生成白色沉淀为硫酸钡,则该实验设计可检验溶液中是否有SO42-,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质鉴别及离子检验等,把握反应原理和实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 在溶液中滴加盐酸酸化,在滴加硝酸钡溶液,若有白色沉淀生成则含有SO42- | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体可能是CO2 |
15.在密闭系统中有反应C(s)+CO2(g)?2CO(g),能使反应速率加快的措施是( )
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎
④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2.
| A. | ①②③⑥ | B. | ①②④⑥ | C. | ①②③④ | D. | ①②③④⑤ |
19.氯气是氯碱工业的主要产品之一,用作为强氧化剂与氯化剂.下列有关氯气及其化合物的叙述正确的是( )
| A. | 氯气与甲烷发生取代反应,是制取二氯甲烷的有效方法 | |
| B. | 红热的铁丝、铜丝都能在氯气里剧烈燃烧,生成大量白色的烟 | |
| C. | 氯气和次氯酸钠都可用于杀菌、消毒,使用时要注意用量 | |
| D. | 聚氯乙烯是使用量非常大,应用领域最为广泛的塑料,也是熟、热食品常用的包装材料 |
16.下列有关除杂的实验操作合理的是( )
| A. | 除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 | |
| B. | 除去硝酸钾晶体里少量的氯化钠:加水溶解,蒸发结晶至有大量晶体析出,停止加热用余热蒸干 | |
| C. | 除去氮气中少量氧气:使气体通过炽热的铜粉 | |
| D. | 除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
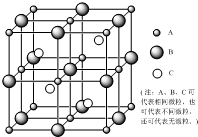 晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:
晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题: