题目内容
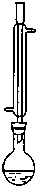 (2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
(2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:①称取0.255g样品.
②将样品与25mL 4mol?L-lNaOH水溶液在100mL圆底烧瓶中混合,水浴加热l小时后停止加热(在如图所示装置中进行反应,发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+NaCl).
③在烧瓶中加入50mL 200/0HN03,混合均匀.
④将烧瓶中溶液全部转移到100mL容量瓶中,加水定容.
⑤从容量瓶中取出25.00mL溶液于锥形瓶中,加入6.25mL 0.100mol?L-1AgNO3溶液,振荡混合均匀.
⑥在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250mol?L-1 NHSCN溶液滴定剩余的AgNO3.
⑦重复⑤、⑥步骤三次,消耗0.0250mol?L1NH4SCN溶液的平均值为6.75mL.(已知:NH4CN+AgNO3=AgSCN↓+NH4NO3)
根据以上实验信息回答下列相关问题:
(1)上图中烧瓶上的冷凝管所起的作用是
冷凝回流作用
冷凝回流作用
.(2)步骤③所加硝酸的目的是
中和NaOH并使溶液呈酸性,防止下一步测定的干扰,
中和NaOH并使溶液呈酸性,防止下一步测定的干扰,
.(3)在步骤⑤操作中,可用
酸式滴定管
酸式滴定管
(填仪器名称)取6.25mL 0.1000mol?L-l的AgNO3溶液.(4)在步骤⑥操作中,判断达到滴定终点的现象是
溶液由无色变为红色,且半分钟内不褪色
溶液由无色变为红色,且半分钟内不褪色
.分析:(1)甲苯、氯化苄的沸点较低,易挥发,烧瓶上的冷凝管起冷凝回流作用;
(2)步骤③所加硝酸的目的是中和NaOH并使溶液呈酸性,防止氢氧根离子对后续测定的干扰;
(3)根据量取硝酸银溶液体积精度为0.01mL,且硝酸银溶液为酸性,选择使用的仪器;
(4)在步骤⑥操作中,用NH4SCN滴定剩余的AgNO3,反应到终点时,SCN-与铁离子反应溶液由无色变为红色,且半分钟内不褪色.
(2)步骤③所加硝酸的目的是中和NaOH并使溶液呈酸性,防止氢氧根离子对后续测定的干扰;
(3)根据量取硝酸银溶液体积精度为0.01mL,且硝酸银溶液为酸性,选择使用的仪器;
(4)在步骤⑥操作中,用NH4SCN滴定剩余的AgNO3,反应到终点时,SCN-与铁离子反应溶液由无色变为红色,且半分钟内不褪色.
解答:解:(1)甲苯、氯化苄的沸点较低,易挥发,烧瓶上的冷凝管起冷凝回流作用,
故答案为:冷凝回流作用;
(2)水解过程会有过量的氢氧化钠,会影响后续的测定,步骤③所加硝酸的目的是中和NaOH并使溶液呈酸性,防止下一步测定的干扰,
故答案为:中和NaOH并使溶液呈酸性,防止下一步测定的干扰,;
(3)量取硝酸银溶液体积精度为0.01mL,且硝酸银溶液为酸性,应使用酸式滴定管,
故答案为:酸式滴定管;
(4)在步骤⑥操作中,用NH4SCN滴定剩余的AgNO3,反应到终点时,SCN-与铁离子反应溶液由无色变为红色,且半分钟内不褪色,
故答案为:溶液由无色变为红色,且半分钟内不褪色.
故答案为:冷凝回流作用;
(2)水解过程会有过量的氢氧化钠,会影响后续的测定,步骤③所加硝酸的目的是中和NaOH并使溶液呈酸性,防止下一步测定的干扰,
故答案为:中和NaOH并使溶液呈酸性,防止下一步测定的干扰,;
(3)量取硝酸银溶液体积精度为0.01mL,且硝酸银溶液为酸性,应使用酸式滴定管,
故答案为:酸式滴定管;
(4)在步骤⑥操作中,用NH4SCN滴定剩余的AgNO3,反应到终点时,SCN-与铁离子反应溶液由无色变为红色,且半分钟内不褪色,
故答案为:溶液由无色变为红色,且半分钟内不褪色.
点评:本题考查化学实验、仪器的用途与选择、滴定原理应用等,难度中等,理解原理是关键,注意掌握实验基本操作.

练习册系列答案
相关题目
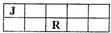 (2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )