题目内容
(2011?杭州一模)某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是:
(2)试通过计算确定该结晶水合物的化学式为
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol?L-1.
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
②若加入75mL的Ba(OH)2溶液,则得到的沉淀质量为
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是:
NH4+
NH4+
和Al3+
Al3+
.(2)试通过计算确定该结晶水合物的化学式为
NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O]
NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O]
.(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol?L-1.
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O
NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O
.②若加入75mL的Ba(OH)2溶液,则得到的沉淀质量为
42.75
42.75
g.分析:(1)能使湿润的红色石蕊试纸变蓝的气体是氨气,证明铵根离子的存在,白色溶于氢氧化钠的沉淀是氢氧化铝,和Ba(OH)2溶液反应生成的白色不溶于硝酸的白色沉淀是硫酸钡;
(2)根据电荷守恒和原子守恒来计算回答;
(3)①根据物质反应的先后顺序确定离子反应方程式;
②n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,根据反应方程式中氢氧化钡和硫酸钡、氢氧化铝之间的关系式计算沉淀质量.
(2)根据电荷守恒和原子守恒来计算回答;
(3)①根据物质反应的先后顺序确定离子反应方程式;
②n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,根据反应方程式中氢氧化钡和硫酸钡、氢氧化铝之间的关系式计算沉淀质量.
解答:解:(1)一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,故答案为:NH4+;Al3+;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=
mol=0.02mol,n(NH4+)=
mol=0.1mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:n(Al3+)=
(2×0.2mol-0.1 mol)=0.1 mol,n(H2O)=
=1.2mol,所以,1.96g的该结晶水合物中:m(NH4+):n(Al3+):n(SO42-):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
该结晶水合物的化学式为NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O],
答:NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O];
(3)①根据反应的先后顺序,开始阶段是氢氧化钠和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钠反应生成偏铝酸钠的阶段,当NH4Al(SO4)2?12H2O和氢氧化钡的物质的量之比为1:2时,两者恰好反应生成硫酸钡、氢氧化铝和一水合氨,此时生成沉淀量最大,离子反应方程式为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O,故答案为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O;
②45.3g晶体的物质的量=
=0.1mol,n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,n(NH4Al(SO4)2):n(Ba(OH)2)=0.1mol:0.15mol=
>
,所以氢氧化钡不足量,根据原子守恒知,生成n(BaSO4)=n(Ba(OH)2)=0.15mol,生成n(Al(OH)3)=
n(Ba(OH)2)=0.1mol,所以沉淀的质量=0.15mol×233g/mol+0.1mol×78g/mol=34.95g+7.8g=42.75g,故答案为:42.75.
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=
| 4.66 |
| 233 |
| 2.24 |
| 22.4 |
| 1 |
| 3 |
| 45.3g-0.1mol×(27+18)g/mol-0.2mol×96g/mol |
| 18g/mol |
该结晶水合物的化学式为NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O],
答:NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O];
(3)①根据反应的先后顺序,开始阶段是氢氧化钠和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钠反应生成偏铝酸钠的阶段,当NH4Al(SO4)2?12H2O和氢氧化钡的物质的量之比为1:2时,两者恰好反应生成硫酸钡、氢氧化铝和一水合氨,此时生成沉淀量最大,离子反应方程式为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O,故答案为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O;
②45.3g晶体的物质的量=
| 45.3g |
| 453g/mol |
| 2 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
点评:本题考查离子的检验和推断,题目难度中等,注意从守恒的角度推断结晶水合物的化学式,注意(3)②中要进行过量计算,为易错点.

练习册系列答案
相关题目
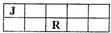 (2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )