题目内容
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、OH-B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-D.Na+、Cu2+、Cl-、SO42-
【答案】D
【解析】
A. K+、H+、SO42-、OH-中,H+与OH-反应不能大量共存,A错误;
B. Na+、Ca2+、CO32-、NO3-中,Ca2+与CO32-反应不能大量共存,B错误;
C. Na+、H+、Cl-、CO32-中,H+与CO32-反应不能大量共存,C错误;
D. Na+、Cu2+、Cl-、SO42-中,不反应可以大量共存,D正确;
答案为D。

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 |
②易分解:SO2Cl2 SO2↑+Cl2↑ |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l)△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的作用是_____________________。
(2)若无装置乙硫酰氯会发生水解,则硫酰氯水解反应的化学方程式为________________。
(3)写出丁装置中发生反应的化学反应方程式并标出电子的转移__________________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为________________________,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___________________。
(6)工业上处理SO2废气的方法很多,例如可以用Fe2(SO4)3酸性溶液处理,其工艺流程如下溶液②转化为溶液③发生反应的离子方程式为__________________________ ;
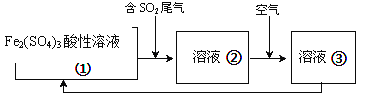
有的工厂用电解法处理含有SO2的尾气,其装置如下图所示(电极材料均为惰性电极)。下列说法不正确的是_______
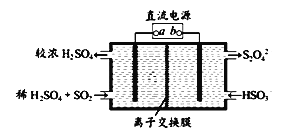
A.电极a连接的是电源的正极
B.若电路中转移0.03mole-,则离子交换膜左侧溶液中增加0.03mol离子
C.图中的离子交换膜是阳离子交换膜
D.阴极的电极反应式为2HSO3-+2e-+2H+==S2O42-+2H2O