题目内容
【题目】一定温度下,对于可逆反应N2(g) +3H2(g) ![]() 2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
A. 恒容容器内混合气体的密度不再变化
B. NH3的生成速率与H2的生成速率之比为2:3
C. 恒压容器内混合气体的总物质的量不再变化
D. 单位时间内断裂a mol N三N键,同时断裂6amol N-H键
【答案】A
【解析】A、组分都是气体,则气体质量不变,容器是恒容状态,因此气体体积不变,因此密度不变不能说明反应达到平衡,故A说法错误;B、用不同物质的反应速率,表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成NH3反应向正反应方向进行,生成H2反应向逆反应方向进行,两者速率之比等于2:3,能说明反应达到平衡,故B说法正确;C、 反应前后气体系数之和不相等,因此当混合气体总物质的量不变时,说明反应达到平衡,故C说法正确;D、断裂amol氮氮三键,说明反应向正反应方向进行,断裂6amolN-H,说明反应向逆反应方向进行,且等于它们的系数之比,能说明达到平衡,故D说法正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各元素最易形成离子化合物的是( )
①第三周期第一电离能最小的元素 ②价电子构型为2s22p6的原子 ③2p能级为半满的元素 ④电负性最大的元素
A. ①② B. ③④ C. ②③ D. ①④
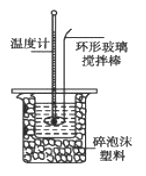
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有1mL浓硫酸的试管中加入5mL0.1mol/L的K2Cr2O7溶液 | 溶液橙色变深 | 增大生成物浓度,平衡Cr2O72-(橙色)+ H20 |
B | 向Mg(OH)2悬浊液中加入少量氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+ |
C | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少里水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D