题目内容
【题目】已知,向相同浓度的醋酸和盐酸中分别加入NaOH溶液,其pH与加入的NaOH溶液的体积变化关系分别如下图I、II所示。室温下,将xmol/L盐酸滴入VmLymol/L的碱溶液中,溶液pH和温度随加入盐酸体积变化曲线如下图III所示。
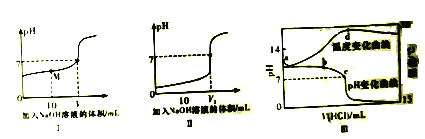
下列说法正确的是
A. 该碱溶液可能是Ba(OH)2溶液
B. c、d两点对应的盐酸体积不同
C. 从图中可判断x约为1, y小于1
D. d点后温度降低,是因为生成的盐发生水解吸热所致
【答案】B
【解析】A. 恰好反应时放热最多,溶液温度最高。而此时溶液的pH小于7,说明生成的盐水解,因此碱是弱碱,A错误;B. c点是中性点,盐酸不足,d点是恰好反应点,因此两点对应的盐酸体积不同,B正确;C. 从图中可知最终溶液的pH接近是0,所以盐酸的浓度约是1。起始时碱溶液的pH小于14,由于是弱碱,所以不能判断弱碱溶液的浓度,C错误;D. 酸碱恰好反应放热最多,则当盐酸过量时,不再反应放热,由于元素的温度低于原混合溶液的温度,则继续滴加元素时,溶液的热量会部分传递给后来滴加的元素溶液,导致温度会降低,D错误,答案选B。

练习册系列答案
相关题目


