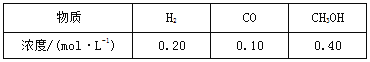题目内容
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
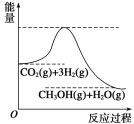
(1)你认为该反应为____________(填放热或吸热)反应.
(2)恒容容器中,对于以上反应,能加快反应速率的是 。
a.升高温度 b.充入He c.加入催化剂 d.降低压强
(3)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
从反应开始到5min末,用H2浓度变化表示的平均反应速率v(H2)= ;反应达到平衡状态,此时H2的转化率为 。
(4)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再变化
b.v生成(CH3OH)=v消耗(CO2)
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.容器中混合气体的密度保持不变
e. H2的消耗速率与CH3OH的消耗速率之比为3∶1
f.体系压强不变
(5)以CH3OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_____________________________________。
【答案】(1)放热;(2)ac;(3)0.15mol·(L·min)-1,75%;(4)a、e、f;(5)CH3OH+8OH―—6e― =CO32―+6H2O。
【解析】
试题分析:(1)反应物的总能量高于生成物的总能量,此反应是放热反应;(2)a、升高温度,反应速率加快;b、恒容时,充入非反应气体,各组分的浓度不变,反应速率不变;c、加入催化剂,加快反应速率;d、降低压强,减缓反应速率;(3)v(CO2)=(1-0.5)/(2×5)mol/(L·min)=0.05 mol/(L·min),根据化学反应速率之比等于系数之比,则v(H2)=3v(CO2)=3×0.05mol/(L·min)=0.15mol/(L·min),消耗的氢气的物质的量n(H2)=3×(1-0.25)mol=2.25mol,氢气的转化率=2.25/3×100%=75%;(4)a、根据化学平衡状态的定义,各组分的浓度不再改变,说明达到平衡;b、生成甲醇和消耗CO2,反应方向都是向正反应方向移动的,因此不能作为达到化学平衡的标志;c、不能通过物质的量比值,来判断达到化学平衡的标志;d、根据密度的定义式,组分都是气体,则气体质量不变,因为是恒容,容器的体积不变,因此密度不能作为达到化学平衡的标志;e、消耗氢气和消耗甲醇反应方向是一正一逆,且速率之比为3:1,能作为达到化学平衡的标志;f、反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡;(5)通燃料的一极为负极,其反应式为:CH3OH+8OH―—6e― =CO32―+6H2O。