��Ŀ����
����Ŀ����1����ȫȼ��0.1 molij����ȼ�ղ�������ͨ��Ũ���ᡢŨ��Һ��ʵ������Ƶ�Ũ��������9 g��Ũ��Һ����17.6 g�������Ļ�ѧʽΪ______����д�������п��ܵĽṹ��ʽ��__________________��
��2��ij��������Է�������Ϊ128���������Ļ�ѧʽΪ__________________��
��3����120 ���101 kPa�������£�ij��̬����һ��������������ϣ���ȼ��ȫ��Ӧ���ٻָ���ԭ�����¶�ʱ�������������������������ڵ���ԭ�Ӹ���______��
A����4 B������4
C������4 D�����ж�
���𰸡���1��C4H10��CH3��CH2��CH2��CH3�� ����2��C9H20����3��C��
����2��C9H20����3��C��
��������
�����������1��Ũ�������������ˮ��Ũ�������ص�����ΪH2O������������Ԫ���غ㣬����n(H)=9��2/18mol=1mol��Ũ�����յ�CO2��Ũ�����ص�CO2������������Ԫ���غ㣬����n(C)=17.6/44mol=0.4mol�����1mol���к�C4mol����HΪ10mol��������ʽΪC4H10�����е�ͬ���칹����������춡�飬��ṹ��ʽ�ֱ��ǣ�CH3��CH2��CH2��CH3�� ����2������������ͨʽCnH2n��2����Է�������Ϊ128����14n+2=128�����n=9������ʽΪC9H20����3��CxHy��(x��y/4)O2��xCO2��y/2H2O���¶ȸ���100������ʱˮ����̬���ڣ���Ӧǰ������������䣬��1��x��y/4=x��y/2�����y=4����ѡ��C��ȷ��
����2������������ͨʽCnH2n��2����Է�������Ϊ128����14n+2=128�����n=9������ʽΪC9H20����3��CxHy��(x��y/4)O2��xCO2��y/2H2O���¶ȸ���100������ʱˮ����̬���ڣ���Ӧǰ������������䣬��1��x��y/4=x��y/2�����y=4����ѡ��C��ȷ��

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ���������ڱ��е�λ�ã���Ԫ�ط��Ż�ѧ����ش��������⣺
�� | IA | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
��1��������ʵ��֤�����ķǽ����Ա���ǿ���� ��
A��Na2CO3+SiO2![]() Na2SiO3+CO2��
Na2SiO3+CO2��
B��SiO2+2C![]() Si+2CO��
Si+2CO��
C��Na2SiO3+CO2+2H2O �� H2SiO3��+Na2CO3
D��CH4��SiH4�ȶ�
��2����������������Ԫ����ɻ�����������ѧ��������_________________��
��3���������������γɵļ����Ӱ뾶�ɴ�С��˳��______������Ԫ�ط��ű�ʾ��
��4����������������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ11�U5�U1��ɵ��л��������к�������-CH3��ͬ���칹���� �֡�
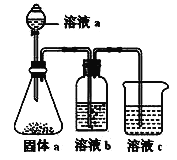
��5��ijͬѧ���ʵ��֤�������������ķǽ�����ǿ����ϵ��
����Һa��b�ֱ�Ϊ_______________��_______________��
����Һc�е����ӷ���ʽΪ______________________��
����Ŀ��Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g�� ![]() CH3OH��g��+H2O��g�����÷�Ӧ�������仯��ͼ��ʾ��
CH3OH��g��+H2O��g�����÷�Ӧ�������仯��ͼ��ʾ��
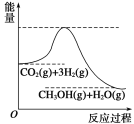
��1������Ϊ�÷�ӦΪ____________������Ȼ���������Ӧ.
��2�����������У��������Ϸ�Ӧ���ܼӿ췴Ӧ���ʵ��� ��
a�������¶� b������He c��������� d������ѹǿ
��3�������Ϊ2 L���ܱ������У�����1 mol CO2��3 mol H2�����CO2�����ʵ�����ʱ��仯���±���ʾ��
t/min | 0 | 2 | 5 | 10 | 15 |
n��CO2��/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
�ӷ�Ӧ��ʼ��5minĩ����H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��H2��= ����Ӧ�ﵽƽ��״̬����ʱH2��ת����Ϊ ��
��4������ͬ�¶ȡ��ݻ�����������£���˵���÷�Ӧ�Ѵ�ƽ��״̬���� �����������
a��CO2��H2��CH3OH��H2O��Ũ�Ⱦ����ٱ仯
b��v������CH3OH����v������CO2��
c��n��CO2����n��H2����n��CH3OH����n��H2O����1��1��1��1
d�������л��������ܶȱ��ֲ���
e�� H2������������CH3OH����������֮��Ϊ3��1
f����ϵѹǿ����
��5����CH3OH������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���Ȼ�ϵ�أ��õ���и����ϵĵ缫��Ӧʽ�ǣ�_____________________________________��
