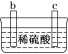
题目内容
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是
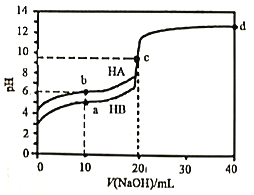
A. 水的电离度:c点溶液>纯水>b点溶液
B. 电离常数:Ka(HA)<Ka(HB)
C. d点溶液:2c(Na+)=c(A-)+(HA)
D. a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
【答案】C
【解析】
0.1mol·L-1的HA和HB溶液pH均大于1,故两者均为弱酸,且HA的酸性更弱,据此分析解答。
A. c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,选项A正确;
B. 由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)<Ka(HB),选项B正确;
C. d点溶液为氢氧化钠与NaA溶液按1:1形成的溶液,根据物料守恒有:c(Na+)=2c(A-)+2 c (HA),选项C错误;
D. a点溶液以HB与NaB按1:1为溶质形成的溶液,溶液呈酸性,说明电离大于水解,则:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),选项D正确。
答案选C。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
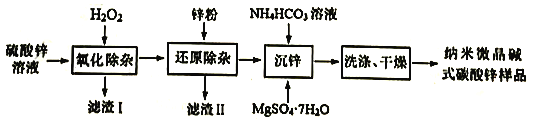
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c