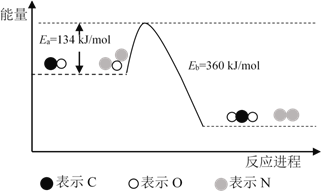
��Ŀ����
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2(g)+![]() O2(g)�TH2O(l) ��H=��285.8kJmol��1
O2(g)�TH2O(l) ��H=��285.8kJmol��1
��H2(g)+![]() O2(g)�TH2O(g) ��H=��241.8kJmol��1
O2(g)�TH2O(g) ��H=��241.8kJmol��1
��C(s)+![]() O2(g)�TCO(g) ��H=��110.5kJmol��1
O2(g)�TCO(g) ��H=��110.5kJmol��1
��CO2(g)�TC(s)+O2(g) ��H=+393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ����___��
��2��H2��ȼ����Ϊ___��C��ȼ����Ϊ___��
��3��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ___��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ___��
���𰸡��٢ڢ� 285.8kJmol��1 393.5kJmol��1 1429kJ CO��g��+![]() O2��g���TCO2��g��
O2��g���TCO2��g�� ![]() H=��283kJmol��1
H=��283kJmol��1
��������
��1���Ȼ�ѧ����ʽ����HΪ��ֵ�ķ�ӦΪ���ȷ�Ӧ����HΪ��ֵ��Ϊ���ȷ�Ӧ��
��2������ȼ���ȵĶ�����⣻
��3�������Ȼ�ѧ����ʽ�з�Ӧ��������ʵ�����֮��Ĺ�ϵ���㡣
��3��������֪���Ȼ�ѧ����ʽ��ϸ�˹���ɼ��㡣
��1���Ȼ�ѧ����ʽ����HΪ��ֵ�ķ�ӦΪ���ȷ�Ӧ����HΪ��ֵ��Ϊ���ȷ�Ӧ������Կ������Ϸ�Ӧ�٢ڢ۾�Ϊ���ȷ�Ӧ�����������ȷ�Ӧ���ʴ�Ϊ���٢ڢۣ�
��2���ɢ��Ȼ�ѧ����ʽ��֪����ȫȼ��1mol��������Һ��ˮ�ų�������Ϊ��285.8kJ����������ȼ����Ϊ��285.8kJmol��1�����ݷ�Ӧ�ܿ�֪����ȫȼ��1molC����CO2���ų�����������393.5kJ����C��ȼ����Ϊ393.5kJmol��1���ʴ�Ϊ��285.8kJmol��1��393.5kJmol��1��
��3���ɢ��Ȼ�ѧ����ʽ��֪����ȫȼ��1mol��������Һ��ˮ�ų�������Ϊ��285.8kJ��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ![]() =1429 kJ���ʴ�Ϊ��1429 kJ��
=1429 kJ���ʴ�Ϊ��1429 kJ��
��4����֪��C��s��+![]() O2(g)�TCO(g)��H=��110.5kJmol��1
O2(g)�TCO(g)��H=��110.5kJmol��1
��CO2(g)�TC��s��+O2(g)��H=+393.5kJmol��1��
�ѷ���ʽ-(��+��)�ã�CO(g)+![]() O2(g)�TCO2(g)��H= -��+393.5kJmol��1��110.5kJmol��1��=��283 kJmol��1���ʴ�Ϊ��CO(g)+
O2(g)�TCO2(g)��H= -��+393.5kJmol��1��110.5kJmol��1��=��283 kJmol��1���ʴ�Ϊ��CO(g)+![]() O2(g)�TCO2(g) ��H=��283 kJmol��1��
O2(g)�TCO2(g) ��H=��283 kJmol��1��

 ����������ϵ�д�
����������ϵ�д�