题目内容
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制一定物质的量浓度的醋酸溶液
取冰醋酸配制250 mL 0.2000 mol/L的醋酸溶液,需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________.
实验二 探究浓度对醋酸电离程度的影响
将0.2000 mol/L的醋酸溶液稀释成所需浓度的溶液,再用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是________.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________.(填“增大”“减小”或“不变”)
答案:
解析:
解析:
|
实验一 胶头滴管(2分)、250 mL容量瓶(2分) 实验二 (1)0.0100 mo1/L醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于l(2分) (2)增大(2分) |

练习册系列答案
相关题目
某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |

 Cu(OH)2+2H+
Cu(OH)2+2H+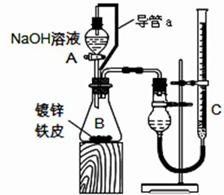 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: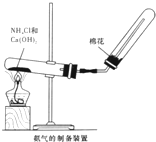 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.