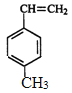
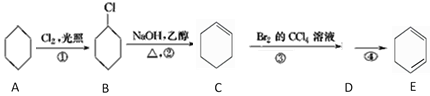
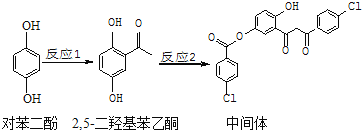
题目内容
【题目】如图是一个铜锌双液原电池装置图,下列说法正确的是

A. 盐桥中的阴离子向CuSO4溶液中移动
B. 盐桥的作用之一是平衡电荷
C. 铜片作电池的负极
D. 电子从锌电极经溶液流向铜电极
【答案】B
【解析】
根据图示可知该装置是原电池,活泼金属锌失电子作负极,发生氧化反应,铜片作正极,电子从负极经过外电路流向正极,据此分析作答。
A.盐桥中的阴离子向负极锌电极区即左侧的硫酸锌溶液中移动,A项错误;
B.负极发生反应Zn-2e-=Zn2+,盐桥中阴离子向ZnSO4溶液中移动,正极反应式为:Cu2++2e-= Cu ,盐桥中阳离子向CuSO4溶液中移动,盐桥的作用是形成闭合回路并平衡电荷,使溶液保持电中性,B项正确;
C. 由于金属活动性Zn>Cu,所以Zn是负极,失去电子,C项错误;
D.电子由负极锌电极通过外电路向铜电极移动,D项错误;
答案选B。

【题目】氯酸钾是常见的氧化剂,用于制造火药、烟火。工业上用石灰乳氯化法制备氯酸钾的流程如图所示:
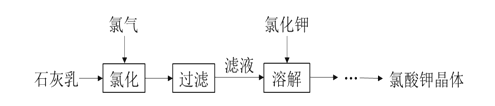
已知:氯化过程主要发生反应:![]()
完成下列填空:
(1)工业生产氯气的方法是________(请用文字表述)。
(2)氯化过程需要控制较高温度,其目的有:①_______;②减少Cl2与Ca(OH)2之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:______。得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_______。
(4)为测定所得晶体中氯酸钾的纯度,将a g样品与b g二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量(g) | c | d | e | e |
(i)进行加热操作时,应将固体置于________(填仪器名称)中。
(ii)该实验不必进行第五次加热的原因是_______。
(iii)若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。______。