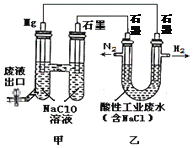
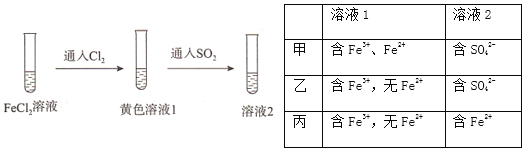
题目内容
【题目】A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题.
(1)固体甲是由元素B、A形成的化合物BA5 , 它的所有原子的最外层都符合相应的稀有气体原子的最外层电结构,固体甲溶解于水有气体放出.则固体甲属于晶体,它的电子式为 . 固体甲溶于水后,溶液呈(酸、碱或中性),写出甲与水反应的化学方程式 .
(2)由C和D形成的化合物乙溶于水能生成一种气体,写出乙与水反应的化学方程式 .
【答案】
(1)离子晶体;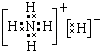 ;碱;NH5+H2O=NH3?H2O+H2↑
;碱;NH5+H2O=NH3?H2O+H2↑
(2)2Na2O2+2H2O=4NaOH+O2↑
【解析】解:(1)N、H在化合物BA5中形成了稀有气体原子的最外层电结构,一个H原子得到一个电子形成H﹣离子,故此化合物为 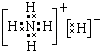 ,属于离子晶体,
,属于离子晶体, 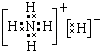 溶于水反应生成一水合氨使溶液呈碱性,反应方程式为NH5+H2O=NH3H2O+H2↑,所以答案是:离子晶体;
溶于水反应生成一水合氨使溶液呈碱性,反应方程式为NH5+H2O=NH3H2O+H2↑,所以答案是:离子晶体; 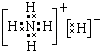 ;碱; NH5+H2O=NH3H2O+H2↑;(2)由O和Na形成的化合物Na2O2溶于水能生成一种气体,Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑, 所以答案是:2Na2O2+2H2O=4NaOH+O2↑.
;碱; NH5+H2O=NH3H2O+H2↑;(2)由O和Na形成的化合物Na2O2溶于水能生成一种气体,Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑, 所以答案是:2Na2O2+2H2O=4NaOH+O2↑.

【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH 步骤中,溶液pH的调节范围是________。
(2)滤渣1和滤渣3 主要成分的化学式分别是________、________。
(3)写出氧化步骤中加入H2O2 发生反应的离子方程式________。
(4)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________g。(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________。