题目内容
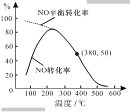
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
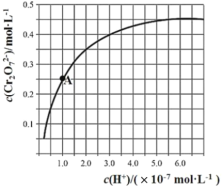
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
【答案】D
【解析】
A.由图可知氢离子浓度越大,c(Cr2O72-)越大,所以pH越小,c(Cr2O72-)越大,故A正确;
B.由图可知A点时Cr2O72-的平衡浓度为0.25mol/L,所以转化的CrO42-的浓度为:0.5mol/L,则A点CrO42-的平衡转化率为50%,故B正确;
C.2CrO42-+2H+![]() Cr2O72-+H2O的平衡常数为:K=
Cr2O72-+H2O的平衡常数为:K=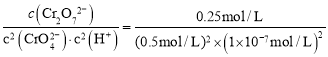 =1014,故C正确;
=1014,故C正确;
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),而2c(Cr2O72-)+c(CrO42-)=1.0molL-1,所以c(Cr2O72-)=![]() molL-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7 molL-1,则溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)<2.0×10-7 molL-1,故D错误;
molL-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7 molL-1,则溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)<2.0×10-7 molL-1,故D错误;
故答案为D。

【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()