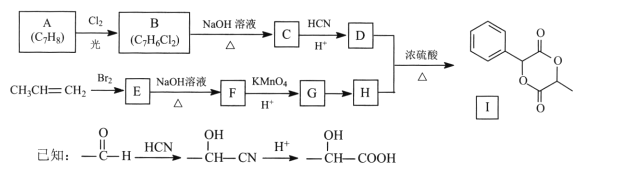
题目内容
【题目】请回答:
(1)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12(如图1)由此可以得到的结论是___(填字母)。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的盐酸和醋酸,滴定曲线如图2所示。
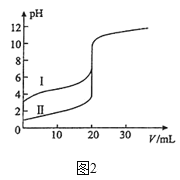
①表示滴定盐酸的曲线是____(填序号)。若此实验选用酚酞为指示剂,则滴定到达终点的现象是____。若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是____。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
②在滴定醋酸溶液的过程中:
V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为____。当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
【答案】ab Ⅱ 当滴入最后一滴NaOH溶液时,溶液由无色变为浅红色,且半分钟不恢复无色 c c(CH3COO-)>c(Na+)>c(H+)>c(OH-) >
【解析】
(1)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱;
a.溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱,故a正确;
b.溶液的pH=5.12,即溶液显酸性,故溶液中c(H+)>c(OH-),故b正确;
c.NH4+水解可看成是盐酸和氨水反应的逆反应,中和反应为放热反应,则水解为吸热反应,但根据该实验无法得到该结论,故c错误;
d.NH4Cl为强酸弱碱盐,在水溶液中能水解,而盐的水解能促进水的电离,故此溶液中由H2O电离出的c(H+)>10-7mol/L,故d错误;
e.物质的量浓度相等的氨水和盐酸等体积混合,会恰好完全反应得NH4Cl溶液,但由于NH4Cl为强酸弱碱盐,水解显酸性,故溶液的pH<7,故e错误;
故答案为ab;
(2)①醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH,所以I是滴定醋酸的曲线,Ⅱ表示的是滴定盐酸的曲线;当滴入最后一滴NaOH溶液时,溶液由无色变为浅红色,且半分钟不恢复无色,说明达到滴定终点;
a.锥形瓶用待测液润洗后再注入待测液,消耗标准液体积偏大,测定结果偏高,故a错误;
b.碱式滴定管滴定前有气泡,滴定后无气泡,则标准液体积读数偏大,测定结果偏高,故b错误;
c.碱式滴定管滴定前仰视读数,滴定后平视读数,则标准液体积读数偏小,测定结果偏低,故c正确;
故答案为c;
②V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故离子浓度的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);当c(Na+)=c(CH3COO-)+c(CH3COOH)时,根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,此时两者恰好完全反应得醋酸钠溶液,而醋酸钠为强碱弱酸盐,水解显碱性,故溶液的pH>7。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。