题目内容
(13分)【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
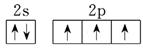
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
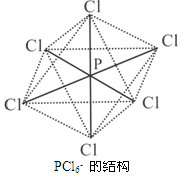
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;
(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;

(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
(1) (2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分);
(2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分);
P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键。(2分)
(4)sp3 (2分) 2:1(2分) (5)C>O>N(2分)
 (2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分);
(2分) (2)离子晶体(1分) 正四面体(1分)(3)是(1分);P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键。(2分)
(4)sp3 (2分) 2:1(2分) (5)C>O>N(2分)
试题分析:(1)N元素是第二周期第ⅤA族元素,原子价电子是5个,根据洪特规则可知,其价电子的轨道表示式为
 。
。(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同,由于氯化铯是由离子键形成的离子晶体,因此PCl5晶体类型是离子晶体;PCl4+中P原子含有的孤对电子对数=
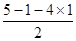 =0,即不存在孤对电子,由于磷原子的价层电子对数是4,所以空间构型是正四面体。
=0,即不存在孤对电子,由于磷原子的价层电子对数是4,所以空间构型是正四面体。(3)由于P原子只有5个价电子,但在该离子中P原子形成了6个共价键,因此必有一个配位键。
(4)NCl3分子中,氮原子的孤对电子对数=
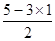 =1,即含有1对孤对电子,因此价层电子对数是4,所以N原子杂化方式是sp3杂化;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g)。氮气中含有三键,氯气中全部是单键,由于单键都是σ键,而三键是由1个σ键和2个π键构成的,因此在分解过程中形成σ键和π键数目之比为(3+1):2=2:1。
=1,即含有1对孤对电子,因此价层电子对数是4,所以N原子杂化方式是sp3杂化;NCl3不稳定,易发生分解:2NCl3(l)=N2(g)+3Cl2(g)。氮气中含有三键,氯气中全部是单键,由于单键都是σ键,而三键是由1个σ键和2个π键构成的,因此在分解过程中形成σ键和π键数目之比为(3+1):2=2:1。(5)碳元素失去4个电子已经达到2电子稳定结构,因此第五电离能最大。而氮元素失去5个电子后也达到2电子的稳定结构,所以氮元素的第五电离能小于氧元素的第五电离能,则C、N、O三种元素的第五电离能(I5)由大到小顺序是C>O>N。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目