题目内容
7.0.5mol某烃A在氧气中完全燃烧后,生成CO2和H2O各2mol.试回答:(1)烃A的分子式为C4H8.
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各6mol,则有84g 烃A参加了反应,燃烧时消耗标准状况下的氧气201.6L.
(3)若烃A能使溴水褪色,不含支链,在核磁共振氢谱中有两组峰,且峰面积比为3:1,则烃A的结构简式为CH3CH=CHCH3.
(4)若烃A能使溴水褪色,则烃A共有3种同分异构体.
分析 (1)根据质量守恒定律确定A分子中含有的C、H原子数,从而得出其分子式;
(2)根据C原子守恒计算出生成6mol二氧化碳消耗A的物质的量,再根据m=nM计算出A的质量;O原子守恒计算出消耗氧气的物质的量,再根据V=nVm计算出消耗标准状况下氧气的体积;
(3)烃A能使溴水褪色,不含支链,则A为1-丁烯或2-丁烯;在核磁共振氢谱中有两组峰,且峰面积比为3:1,说明A具有对称结构,含有2种H,据此确定其结构简式;
(4)烃A能使溴水褪色,说明A分子中含有碳碳双键,则A为丁烯,根据同分异构体的书写原则写出A的结构简式.
解答 解:(1)0.5mol烃A在氧气中完全燃烧后生成CO2和H2O各2mol,根据质量守恒定律可知A分子中含有的C、H原子数分别为:N(C)=$\frac{2mol}{0.5mol}$=4、N(H)=$\frac{2mol×2}{0.5mol}$=8,
所以A的分子式为:,
故答案为:C4H8;
(2)取一定量的该烃A完全燃烧后生成CO2和H2O各6mol,根据C原子守恒可知消耗A的物质的量为:$\frac{6mol}{4}$=1.5mol,1.5molA的质量为:56g/mol×1.5mol=64g;
6molCO2和H2O中含有O的物质的量为:6mol×2+6mol×1=18mol,根据O元素守恒可知消耗氧气的物质的量为:$\frac{18mol}{2}$=9mol,标准状况下9molA的体积为:22.4L/mol×9mol=201.6L,
故答案为:84;201.6;
(3)若烃A能使溴水褪色,不含支链,其结构简式可能为:CH3CH=CHCH3或CH2=CHCH2CH3,又由于在核磁共振氢谱中有两组峰,且峰面积比为3:1,则A分子中含有2种H,所以A的结构简式为:CH3CH=CHCH3,
故答案为:CH3CH=CHCH3;
(4)烃A能使溴水褪色,则A分子中含有碳碳双键,满足条件的结构简式为:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)CH3,总共含有3种同分异构体,
故答案为:3.
点评 本题考查了有机物分子式、结构简式的确定方法,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的书写原则,能够利用质量守恒定律确定有机物的分子式,试题培养了学生的化学计算能力.

| A. | 氯化钡 | B. | 浓氨水 | C. | 二氧化碳 | D. | 乙醇 |
| A. | 冰 | B. | NH3晶体 | C. | HCl晶体 | D. | P4010晶体 |
 CH3COOCH2CH3+H2O,属于酯化(取代)反应.
CH3COOCH2CH3+H2O,属于酯化(取代)反应.
 L B.
L B.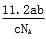 L
L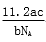 L D.
L D. L
L