��Ŀ����
����Ŀ����1����ҵ�ϳ�����Ϊԭ���Ʊ����ᣬ������һ���dz���Ҫ�ķ�ӦΪ
4NH3+5O2![]() 4NO+6H2O���÷�Ӧ��������Ϊ______����ԭ��Ϊ______���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ____________________________________��
4NO+6H2O���÷�Ӧ��������Ϊ______����ԭ��Ϊ______���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ____________________________________��
���б�״����VL������ȫ��Ӧ����ת��n�����ӣ���٤��������NA���ɱ�ʾΪ__________________��д����n��V�ı���ʽ����
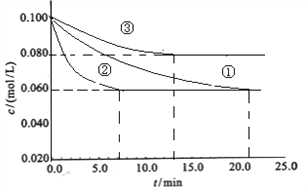
��2��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S�� H2S��HNO3��NO��H2O����֪������һ�ַ�Ӧ��÷�Ӧ�л�ԭ������________������Ӧ��ת����0.3mol���ӣ������������������_____g��
��3����Ҫ����գ�
����ȥ̼��������Һ�е�̼����______________________�������ӷ���ʽ��ʾԭ������
����ȥ̼������Һ�е�̼�����ƣ�Ӧ���Լ�Ϊ________________��
��������������ȥ������Һ�е������__________________�������ӷ���ʽ��ʾԭ������
���𰸡�O2 NH3 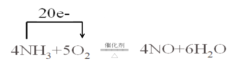 4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ����������������Һ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O
4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ����������������Һ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O
��������
��Ӧ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�OԪ�ػ��ϼ���0�۽��͵�-2�ۣ���ϻ��ϼ۵ı仯�����⡣NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol��������2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽���������Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S![]() S����Ӧ����ʽ��
S����Ӧ����ʽ��![]() ����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������̼���������������Ʒ�Ӧ����̼���ƺ�ˮ����������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2��
����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������̼���������������Ʒ�Ӧ����̼���ƺ�ˮ����������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2��
��Ӧ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�OԪ�ػ��ϼ���0�۽��͵�-2�ۣ���Ӧ��O2Ϊ��������NH3Ϊ��ԭ���������ŷ���ʾ�÷�Ӧ����ת�Ƶķ������ĿΪ ����״����VL���������ʵ�����
����״����VL���������ʵ�����![]() ��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol���ӣ���
��NԪ�ػ��ϼ���-3�����ߵ�+2�ۣ�1mol������Ӧ��ת��5mol���ӣ���![]() ��NA =4.48n/Vmol-1����2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽��ͣ�����NO�ǻ�ԭ�����Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S
��NA =4.48n/Vmol-1����2������������ԭ��Ӧ���ɣ�������һ�ַ�Ӧ���NO����������NԪ�ػ��ϼ۽��ͣ�����NO�ǻ�ԭ�����Ԫ�ػ��ϼ����ߣ�������Ӧ��H2S![]() S�������������������ݷ�Ӧ����ʽ
S�������������������ݷ�Ӧ����ʽ![]() ��ת��6mol����������3molS����ת��0.3mol���ӣ�����0.15mol S�����������4.8g����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������Ӧ�����ӷ���ʽ��CO32-+ H2O+ CO2 = 2HCO3-����̼���������������Ʒ�Ӧ����̼���ƺ�ˮ���������ƿ��Գ�ȥ̼������Һ�е�̼����������������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2����Ӧ���ӷ���ʽ��Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O��
��ת��6mol����������3molS����ת��0.3mol���ӣ�����0.15mol S�����������4.8g����3����ͨ�������̼���Գ�ȥ̼��������Һ�е�̼��������Ӧ�����ӷ���ʽ��CO32-+ H2O+ CO2 = 2HCO3-����̼���������������Ʒ�Ӧ����̼���ƺ�ˮ���������ƿ��Գ�ȥ̼������Һ�е�̼����������������������ȥ������Һ�����������Ҫ�������������������ʵ�����Ϊ1:2����Ӧ���ӷ���ʽ��Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4�� + 2H2O��