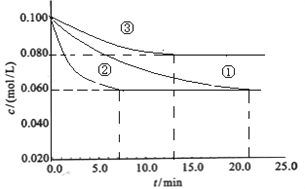
题目内容
【题目】等体积的硫酸钾、硫酸铜、硫酸铝溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
A. 1:2:3 B. 1:6:9 C. 1:2:1 D. 3:2:1
【答案】C
【解析】
等体积的K2SO4、CuSO4、Al2(SO4)3三种溶液分别与BaCl2溶液恰好完全反应,生成硫酸钡的物质的量比为1:2:3,设生成硫酸钡的物质的量分别是1mol、2 mol、3 mol,根据化学方程式可计算K2SO4、CuSO4、Al2(SO4)3三种溶液的浓度。
生成硫酸钡的物质的量分别是1mol、2 mol、3 mol,设K2SO4、CuSO4、Al2(SO4)3三种溶液的浓度分别是![]() 、
、![]() 、
、![]() ;
;
K2SO4+ BaCl2= BaSO4![]() + 2NaCl
+ 2NaCl
1 1
![]() 1
1
![]()
CuSO4+ BaCl2=BaSO4![]() +CuCl2
+CuCl2
1 1
![]() 2
2
![]()
Al2(SO4)3+ 3BaCl2=3BaSO4![]() + 2AlCl3
+ 2AlCl3
1 3
![]() 3
3
![]()
K2SO4、CuSO4、Al2(SO4)3三种溶液的浓度比为![]() :
:![]() :
:![]() =1:1:1,故选C。
=1:1:1,故选C。

练习册系列答案
相关题目
【题目】下列实验能达到相应目的的是( )
选项 | A | B | C | D |
实验过程 |
|
|
|
|
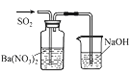
实验目的 | 将乙二醇转化为乙二酸 | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D