题目内容
17.有二氧化碳与一氧化碳的混合气体共10.8g,其物质的量为0.3mol,求:(1)混合气体中二氧化碳的物质的量为0.15 mol,一氧化碳的物质的量为0.15 mol
(2)混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体的质量为4.2 g,所含分子数为9.03×1022
(3)等质量的氧气和臭氧(O3)物质的量之比为3:2,所含氧原子之比为1:1
(4)NO和O2可发生反应2NO+O2═2NO2,现有amolNO和bmolO2充分反应后氮原子和氢原子的个数比为a:(a+2b).
分析 (1)已知M(CO)=28g/mol,M(CO2)=44g/mol,设混合气体中CO2的物质的量为x,CO的物质的量为y,根据混合气体的物质的量,结合质量列方程组计算;
(2)氢氧化钠溶液稀释二氧化碳,剩余气体为CO,结合(1)计算可知CO的物质的量,根据N=nNA计算CO分子数目;
(3)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$进行相关量的计算;
(4)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,据此分析解答.
解答 解:(1)设混合气体中CO2的物质的量为x,CO的物质的量为y.则:x+y=0.3mol,44 g•mol-1×x+28 g•mol-1×y=10.8 g,
解得x=0.15 mol,y=0.15 mol,
故答案为:0.15 mol、0.15 mol;
(2)混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体为CO,质量为0.15mol×28g/mol=4.2g,所含CO分子数目为0.15mol×6.02×1023mol-1=9.03×1022,
故答案为:4.2 g;9.03×1022;
(3)设质量都为mg,则有:n(O2):n(O3)=$\frac{mg}{32g/mol}$:$\frac{mg}{48g/mol}$=3:2,由于都由O原子组成,则质量相同时O原子个数相同,比值为1:1,
故答案为:3:2;1:1;
(4)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,根据N=nNA知,各种元素的原子个数之比等于其物质的量之比,n(N):n(O)=n(NO):[n(NO)+2n(O2)]=amol:(a+2b)mol=a:(a+2b),
故答案为:a:(a+2b).
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意根据物质的量和质量列方程式计算.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | 浓硫酸 | B. | 钠 | C. | 碱石灰 | D. | 无水硫酸铜 |
| A. | 该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯 | |
| B. | 有一种同分异构体的名称为:2,2-二甲基-1-丙烯 | |
| C. | 其属于烯烃的同分异构体有5种 | |
| D. | 该物质的可能结构中最多有两个侧链 |
| A. | 2mol | B. | 6.02×1023个 | C. | 0.5mol | D. | 1mol |
| A. | 3.0g C2H6中含有共用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=-a kg•mol-1,将2NA个CO与NA个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
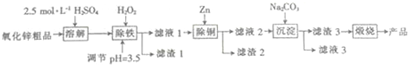
已知溶液中Fe2+、Fe3+、Cu2+、Zn2+以氢氧化物的形式沉淀时的pH如表格:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
(2)上述流程图中用的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-).
(3)滤渣1是Fe(OH)3(填化学式).加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)纳米活性氧化锌可用作氯乙烯聚合制取聚氯乙烯的催化剂,写出该反应的化学方程式:nCH2=CHCl$\stackrel{纳米活性氧化锌}{→}$
 .
.  (1)中和热测定实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒
(1)中和热测定实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒