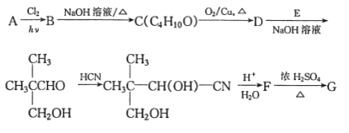
题目内容
【题目】在1273 K时,有如下反应:FeO(s) + CO(g) ![]() Fe(s) + CO2(g) K = 0.5
Fe(s) + CO2(g) K = 0.5
(1)、请写出求此反应平衡常数K的数学表达式:K=_____________________。
(2)、如果CO和CO2的起始浓度为下列数值:c (CO) = 0.05 mol·L--1 ,c (CO2) = 0.01 mol·L--1 ,求它们的平衡浓度_________。(写出计算过程)
(3)、平衡时,求CO的转化率为________________(不用写计算过程)。
【答案】 ![]() 解:设CO的转化浓度为x
解:设CO的转化浓度为x
FeO(s) + CO(g) ![]() Fe(s) + CO2(g)
Fe(s) + CO2(g)
c0/mol·L--1 0.05 0.01
Δc/ mol·L--1 x x
c(平)/ mol·L--1 0.05 -- x 0.01 + x
![]() 解得:x = 0.01 mol·L--1
解得:x = 0.01 mol·L--1
则c (CO) = 0.05 mol·L--1 -- 0.01 mol·L--1 = 0.04 mol·L--1
c (CO2) = 0.01 mol·L--1 + 0.01 mol·L--1 = 0.02 mol·L--1 20%
【解析】本题主要考查关于平衡常数的计算。
(1)此反应平衡常数K的数学表达式:K=![]() 。
。
(2)设CO的转化浓度为xmol·L-1,则CO和CO2的平衡浓度为:c(CO)=(0.05-x)mol·L-1,c(CO2)=(0.01+x)mol·L-1, ![]() ,解得:x=0.01。
,解得:x=0.01。
CO和CO2的平衡浓度为:c(CO)=(0.05-x)mol·L--1,=0.04 mol·L-1,c(CO2)=(0.01+x)mol·L--1=0.02mol·L-1。
(3)平衡时,CO的转化率为x/0.05=20%。

【题目】某温度下,H2(g) + CO2(g) ![]() H2O(g)+ CO(g)的平衡常数K=9/4。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和 CO2(g),其起始浓度如下表所示
H2O(g)+ CO(g)的平衡常数K=9/4。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和 CO2(g),其起始浓度如下表所示
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/ mol·l-1 | 0.010 | 0.020 | 0.020 |
C(CO2)/ mol·l-1 | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A. 平衡时,乙中CO2 的转化率大于60%
B. 平衡时,甲和丙中H2 的转化率均是60%
C. 平衡时,丙中C(CO2)是甲中的2倍,是0.012 mol·l-1
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢