题目内容
(15分)硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
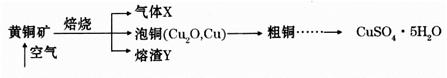
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
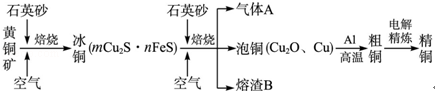
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
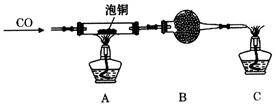
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。

Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
(15分)(1)H4SiO4(2分)
(2)A (2分)
(3)Al3+(2分)
(4)错误(3分)
(5)Fe2+- e-=Fe3+(2分)
(6)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)  R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生 (2分)
(7) c(H+)>c(SO42-)>c(Cu2+)>c(OH-)(2分)
解析试题分析:(1)根据质量守恒定律,空白处的物质是H4SiO4;
(2)步骤②调节溶液pH的目的是除去铁离子等杂质,所以调节pH不能引入新的杂质,所以答案选A;(3)pH=4时铁离子完全沉淀,但Al3+完全沉淀的pH=5.2,所以当溶液pH=4时,不能完全除去的离子 是 Al3+;
(4))PH=4时,溶液中的氢氧根离子的浓度为:1×10-10mol/L,此时氢氧化铝已沉淀,则溶液中铝离子浓为:3.2×10-34/(1×10-10)3=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出,所以该同学的观点错误;
(5)阳极发生氧化反应,黄铜矿粉与硫酸及硫酸铁反应生成的亚铁离子被氧化生成铁离子,导致阳极区的铁离子的浓度基本不变,电极反应式为Fe2+- e-=Fe3+;
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,使水相中的氢离子浓度增大,平衡逆向移动,Cu2+进入水相得以再生;
(7)电解0.1mol CuSO4溶液,生成铜3.2 g,转移电子0.1mol,阳极氢氧根离子放电,生成0.025mol氧气的同时,使溶液中的氢离子增加0.1mol,则溶液中仍存在0.05mol Cu2+,SO42-的物质的量不变,仍是0.1mol,所以此时溶液中离子浓度的大小关系为c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
考点:考查质量守恒定律的应用,试剂的选择,电化学原理的应用,化学平衡的移动,离子浓度的比较

 ”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是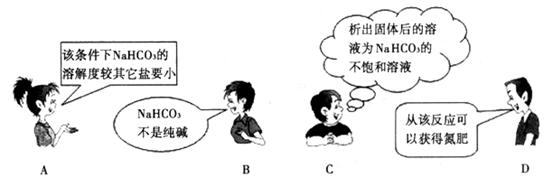
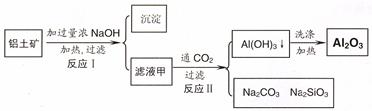
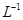 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: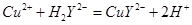 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。