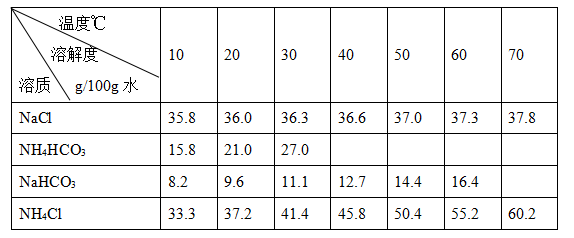
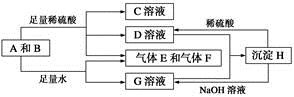
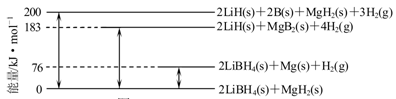
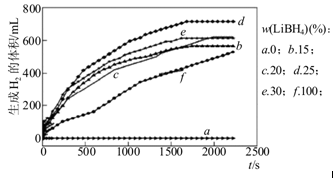
题目内容
(12分)(2012?山东)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: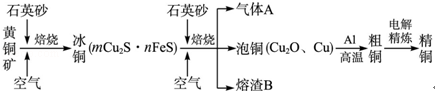
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 .
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 .
(1)cd(2)Fe3+;取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去(3)3Cu2O+2Al Al2O3+6Cu(4)bd(5)4H++O2+4e﹣=2H2O
Al2O3+6Cu(4)bd(5)4H++O2+4e﹣=2H2O
解析

(12分)某研究性学习小组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体中燃烧。他们对钠在CO2气体中燃烧进行了下列实验:
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
a.水 b.泡沫灭火剂 c.干沙土 d.二氧化碳
(2)该小组同学对瓶壁上的白色物质的成分进行讨论并提出假设
I.白色物质是Na2O;
II.白色物质是Na2CO3;
III.白色物质还可能是
(3)
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②写出该反应的方程式 。
(15分)硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
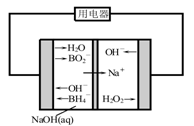
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。

Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: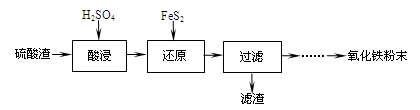
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。


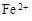 和
和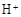 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。