��Ŀ����
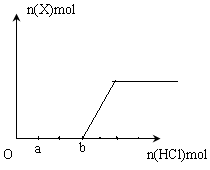
��10�֣� ij��ȤС����С����ý������ᷴӦ����ʵ�飬��5��4g����ƬͶ��500 mL 0��5 mol��L-1��������Һ�У���ͼΪ��Ӧ�������������뷴Ӧʱ��Ĺ�ϵͼ��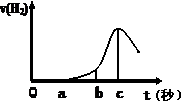
��1������ͼ�����������ȷ���� ������ţ���ͬ����
�� o��a�β���������H2�����¹��ͣ���Ӧ���Է�����
�� b �� c�β���H2�Ͽ�����Ƿ�Ӧ���ȣ��¶����ߣ��ӿ��˷�Ӧ
�� c�Ժ���H2�������½�ԭ���������Ƭ����������ȫ
��2����b��c���ʱ���ڣ��ռ�������VL����״�����������ʱ�����������ʾ��ƽ������Ϊ mol/(L��s)�����跴Ӧǰ����Һ������䣩��
��3�������������䣬�ֻ���500 mL 1 mol��L-1���ᣬ�������������ձ��ʹ��500 mL 0��5 mol��L-1����Ŀ죬���ܵ�ԭ����________��
��4��Ҫ�ӿ�����������Һ��H2�ķ�Ӧ���ʣ�С���Ա���һϵ�з�������������������
�ټ���2 mol��L-1����ڼ�������CuSO4��Һ �۽���Ƭ�������� �����������Ũ����18 mol/L �ݼ�CH3COONa���壻 ��������Na2SO4��Һ
��5��������Ӱ�췴Ӧ���ʣ�����ݢٷ�Ӧд��FeCl3��H2O2�ֽ����һ��Ӧԭ���������ӷ���ʽ����2Fe3++ H2O2= 2Fe2++ 2H+ +O2������ ��
��1���٢ۣ���2��V/11.2��c��b�� mol/(L��s)����3���������ɴ����û���������軯���ã���4���ڢۣ���5����2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O��
���������������1���� o��a�β���������H2�����ڽ�����������һ������Ĥ����������ϡ���ᷴӦ������������ˮ������ b �� c�β���H2�Ͽ�����Ƿ�Ӧ���ȣ��¶����ߣ��ӿ��˷�Ӧ����ȷ���� �����������֪����������c�Ժ���H2�������½�ԭ�������ϡ��������������ȫ������ѡ�٢ۣ���2����b��c���ʱ���ڣ��ռ�������VL����״���������ʵ���ΪV/22.4mol��ʱ��Ϊ��c��b��s,��������ʵ����仯ΪV/22.4mol�������ʱ�����������ʾ��ƽ������ΪV/11.2��c��b�� mol/(L��s)����3�������������䣬�ֻ���500 mL 1 mol��L-1���ᣬ�������������ձ��ʹ��500 mL 0��5 mol��L-1����Ŀ죬���ܵ�ԭ�����������ɴ����û���������軯���ã���4���ټ���2 mol��L-1���ᣬ�������ǿ�����ԣ�������Ӧ�������������ڼ�������CuSO4��Һ�����û���ͭ���γ�ԭ��أ���Ӧ���ʼӿ죬��ȷ�� �۽���Ƭ�������� ������Ӧ��ĽӴ��������Ӧ���ʼӿ죬��ȷ�������������Ũ����18 mol/L ������Ũ����ۻ�����ֹ��Ӧ���У����ݼ�CH3COONa���壬����������Ʒ�Ӧ���ɴ��ᣬ������Ũ�Ƚ�С����Ӧ���ʼ��������� ��������Na2SO4��Һ��������ϡ�ͣ���Ӧ���ʼ���������ѡ�ڢۣ���5��������Ӱ�췴Ӧ���ʣ�����ݢٷ�Ӧд��FeCl3��H2O2�ֽ����һ��Ӧԭ���������ӷ���ʽ����2Fe3++ H2O2= 2Fe2++ 2H+ +O2������2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O��
���㣺

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д����������ֱ������������ᡢˮ������һ���������³�ַ�Ӧ��������ͬ�������£������������������
| A��1:1 | B��3:4 | C��2:3 | D��4:3 |
��ag Mg��Al�Ͻ���ȫ�ܽ���V1L��c1mol/L��������Һ�У�����bgH2������Ӧ�����Һ�м���V2L,c2mol/LNaOH��Һ��ǡ��ʹ�����ﵽ���ֵ���ҳ�������Ϊdg�������й�ϵʽ�������( )
| A���Ͻ��е����ʵ���Ϊ(24b-a)/9mol |
| B��d=a+17b |
C��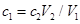 |
D���������Ӧ��ʣ����������ʵ���Ũ��Ϊ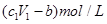 |
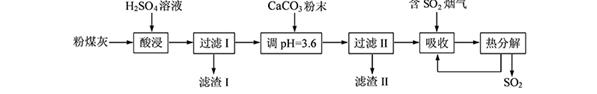
��15�֣�����ͭ�ڻ�����ũҵ�����кܹ㷺���ô���ij��ѧ��ȤС��������ϣ������ֲ�ͬ��ԭ����ȡ����ͭ��
��ʽһ��һ�ֺ�ͭ�Ŀ�ʯ�����ȸʯ��ۣ�����ͭ��̬ΪCuCO3��Cu(OH)2��CuSiO3��2H2O������SiO2��FeCO3��Fe2O3��Al2O3�����ʣ��������ֿ�ʯΪԭ����ȡ����ͭ�Ĺ�����������ͼ��
��ش��������⣺
����ɲ������ϡ������CuSiO3��2H2O������Ӧ�Ļ�ѧ����ʽ
CuSiO3��2H2O+H2SO4=CuSO4 +________+H2O��
�Ʋ���ڵ�����ҺpHѡ�õ�����Լ���__________________
A. CuO B. MgO C. FeCO3 D NH3��H2O
���й��������↑ʼ��������ȫ������pH���±���
| �������� | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| ��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 |
| ������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 |
����ҺBͨ������Ũ���������Ũ��Ϊԭ����һ�룩����ȴ�ᾧ���Եõ�CuSO4��5H2O���塣ijͬѧ��Ϊ������������������������������������������ݶԸ�ͬѧ�Ĺ۵��������ۣ���֪�����£�Al2(SO4)3 ������Һ��C(Al3+)=2.25mol��L-1��Ksp[Al(OH)3]=3.2��10-34) ________�����ȷ��������
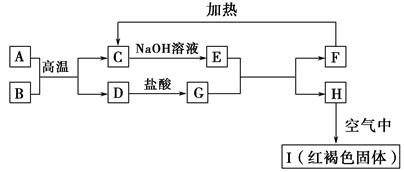
��ʽ�����Ի�ͭ��Ϊԭ�ϣ���ȡ����ͭ������ͭ�Ĺ���������ʾ��
��.����ͭ����Ҫ�ɷ�ΪCuFeS2����������CaO��MgO��Al2O3������
��.��������װ�ý��е绯ѧ����ʵ�飬����ѡ��ͭ��ۼ�����������������ٽ��裬ʹ����ܽ⡣��������ͨ������������������������

��.һ��ʱ���ȡ��������Һ�������м����л���ȡ����RH��������Ӧ��
2RH���л��ࣩ+ Cu2+��ˮ�ࣩ
 R2Cu���л��ࣩ+ 2H����ˮ�ࣩ
R2Cu���л��ࣩ+ 2H����ˮ�ࣩ������л��࣬�����м���һ��Ũ�ȵ����ᣬʹCu2+����������
��.�������ͭ��Һ�Ƶý���ͭ��
��5����ͭ��ۼ��������������ἰ��������Ҫ�������·�Ӧ��
CuFeS2 + 4H�� = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S��+ 2H��
�������У�������Fe3+��Ũ�Ȼ������ֲ��䣬ԭ����____________________���õ缫��Ӧʽ��ʾ����
��6����������л����м���һ��Ũ�ȵ����ᣬCu2+����������ԭ����_____________ ��
��7��������������0.1mol CuSO4��Һ������ͭ3.2 g����ʱ��Һ������Ũ���ɴ�С��˳���� ____ ��



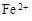 ��
��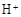 �⣬�����ܴ���������������������Ԫ�ط��ű�ʾ����
�⣬�����ܴ���������������������Ԫ�ط��ű�ʾ����