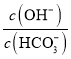题目内容
【题目】Ⅰ 将pH=13的Ba(OH)2溶液与pH=2的稀盐酸混合,并保持25℃的恒温,使混合后pH=11(混合后溶液体积为混合前两溶液体积之和),则稀盐酸与Ba(OH)2溶液的体积比为_________;
Ⅱ 硫酸是强酸,中学阶段将硫酸在水中的电离看做完全电离。但事实是,硫酸在水中的第一步电离是完全的第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-;HSO4-![]() H++SO42-。根据事实回答下列有关问题:
H++SO42-。根据事实回答下列有关问题:
① Na2SO4溶液呈_________(填“酸性”、“碱性”或“中性” ),原因是___________________(用离子方程式表示) 。
② 某温度下, 在0.1 mol/L 的NaHSO4溶液中逐滴加入0.1 mol/LKOH溶液至溶液呈中性(混合后溶液体积为混合前两溶液体积之和)。此时该混合溶液中的下列关系正确的是_______(填字母)
A.C(SO42-)+C(HSO4-)+C(H2SO4)=C(Na+)
B.C(H+)×C(OH-)=1×10-14
C.C(Na+)+C(K+)=C(HSO4-)+2C(SO42-)
D.C(Na+)>C(K+)
③ H2SO4溶液和BaCl2溶液反应的离子方程式为___________________________
Ⅲ CaCO3是一种难溶物质,其Ksp=2.8×10-9,CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合(混合后溶液体积为混合前两溶液体积之和),若Na2CO3溶液的浓度为4×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________ mol/L。
【答案】 9 :1 碱性 SO42- + H2O ![]() HSO4- +OH- CD HSO4-+Ba2+= BaSO4↓+ H+ 2.8×10-5
HSO4- +OH- CD HSO4-+Ba2+= BaSO4↓+ H+ 2.8×10-5
【解析】Ⅰ、混合后pH=11,说明氢氧化钡过量,则![]() ,解得V2:V1=9:1;
,解得V2:V1=9:1;
Ⅱ、①根据HSO4-![]() H+ +SO42-可知硫酸根水解,所以Na2SO4溶液呈碱性。②某温度下, 在0.1 mol/L 的NaHSO4溶液中逐滴加入0.1 mol/LKOH溶液至溶液呈中性(混合后溶液体积为混合前两溶液体积之和),这说明所得溶液是硫酸盐和硫酸氢盐的混合溶液,则A.溶液中不存在硫酸分子,A错误;B.温度不能确定,水的离子积常数不一定是1 ×10-14,B错误;C.根据电荷守恒可知c(Na+) + c(K+) = c(HSO4-)+2c(SO42-),C正确;D.反应中硫酸氢钠过量,则溶液中c(Na+)>c(K+),D正确,答案选CD。③由于硫酸的第二步电离不完全,则H2SO4溶液和BaCl2溶液反应的离子方程式为HSO4-+Ba2+= BaSO4↓+ H+;
H+ +SO42-可知硫酸根水解,所以Na2SO4溶液呈碱性。②某温度下, 在0.1 mol/L 的NaHSO4溶液中逐滴加入0.1 mol/LKOH溶液至溶液呈中性(混合后溶液体积为混合前两溶液体积之和),这说明所得溶液是硫酸盐和硫酸氢盐的混合溶液,则A.溶液中不存在硫酸分子,A错误;B.温度不能确定,水的离子积常数不一定是1 ×10-14,B错误;C.根据电荷守恒可知c(Na+) + c(K+) = c(HSO4-)+2c(SO42-),C正确;D.反应中硫酸氢钠过量,则溶液中c(Na+)>c(K+),D正确,答案选CD。③由于硫酸的第二步电离不完全,则H2SO4溶液和BaCl2溶液反应的离子方程式为HSO4-+Ba2+= BaSO4↓+ H+;
Ⅲ、Na2CO3溶液的浓度为4×10-4 mol/L,等体积混合后溶液中c(CO32-)=0.5×4×10-4 mol/L =2×10-4 mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×109 /2×104
mol/L=1.4×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×1.4×10-5mol/L=2.8×10-5mol/L。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】下列物质的性质与实际应用的对应关系正确的是
选项 | 物质的性质 | 实际应用 |
A | 液氨具有碱性 | 作冷库中的制冷剂 |
B | FeCl3水溶液显酸性 | 蚀刻铜制线路板 |
C | 石墨具有导电性 | 作干电池正极材料 |
D | Al2O3是两性氧化物 | 作耐火材料 |
A. AB. BC. CD. D
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是 ( )
加入的物质 | 结论 | |
A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.05molCaO | 溶液中 |
A. A B. B C. C D. D