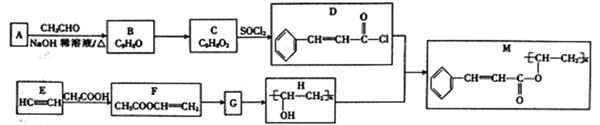
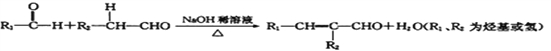题目内容
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B. 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C. 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
【答案】D
【解析】试题分析:A.苯与浓硝酸在浓硫酸在加热条件下,发生取代反应生成硝基苯与水,反应方程式为![]() ,故A正确;B.苯环在一定条件下能发生加成反应,苯环上连接的碳碳双键易发生加成反应,1摩尔
,故A正确;B.苯环在一定条件下能发生加成反应,苯环上连接的碳碳双键易发生加成反应,1摩尔![]() 能与4摩尔氢气发生加成反应,生成乙基环己烷,故B正确;C.乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,生成1,2-二溴乙烷,故C正确;D.甲苯与氯气在光照条件下能发生取代反应,此时只能取代甲基上的氢原子,不能取代苯环上的氢原子,氢原子的取代是分部同时进行的,一元取代物只取代甲基上的一个氢原子,
能与4摩尔氢气发生加成反应,生成乙基环己烷,故B正确;C.乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,生成1,2-二溴乙烷,故C正确;D.甲苯与氯气在光照条件下能发生取代反应,此时只能取代甲基上的氢原子,不能取代苯环上的氢原子,氢原子的取代是分部同时进行的,一元取代物只取代甲基上的一个氢原子,![]() ,故D错误;故选D。
,故D错误;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 溴苯(溴) | NaOH溶液 | 分液 |
A. AB. BC. CD. D