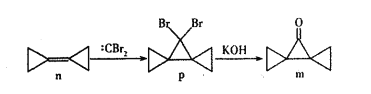
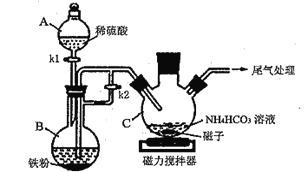
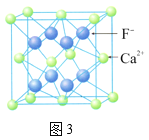
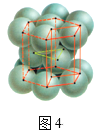
题目内容
【题目】光气(COCl2),又称碳酰氯,常温下为无色气体,剧毒。化学性质不稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间体。氯仿(CHCl3)被氧化可产生光气2CHCl3+O2→2HCl+2COCl2。下列说法正确的是( )
A.CHCl3的立体构型为正四面体
B.COCl2为平面型分子,中心C原子采用sp2杂化
C.CHCl3和COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.CHCl3是手性分子,存在手性异构体
【答案】B
【解析】
A.CH4是正四面体结构,但C—H与C—Cl键长不等,CHCl3分子的空间构型为四面体,但不是正四面体,A选项错误;
B.COCl2分子的中心原子的价层电子对数为![]() ,不含有孤对电子,中心C原子采用sp2杂化,空间构型为平面三角形,B选项正确;
,不含有孤对电子,中心C原子采用sp2杂化,空间构型为平面三角形,B选项正确;
C.COCl2中C原子形成了四对共用电子对,O原子形成了2对共用电子对,每个氯原子形成一对共用电子对,所有原子最外层都满足8电子结构,但CHCl3中H原子最外层只有2个电子,C选项错误;
D.CHCl3中C原子周围有1个氢原子和3个Cl原子,不是手性分子,不存在手性异构,D选项错误;
答案选B。

【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.混合气体的密度不变
D.c(CO)=c(CO2)
E.化学平衡常数K不变
F.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为___。