��Ŀ����
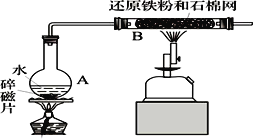
����Ŀ��ʵ�����ú������ʣ�FeO��Fe2O3���ķ�CuO�Ʊ��������壬���������й��̣���֪ Fe3+�� pH=5ʱ������ȫ�������з����������

A. ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O
B. ����ڲ�������ˮ�������ǿ����������H2O2
C. �����Ϊ���ˣ�����������ᾧ
D. ������� CuCO3����CuOҲ�ɵ�����Һ��pH
���𰸡�C
��������
A. �����Ϊ������������������������ԭ��Ӧ�����ӷ�ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O����A��ȷ��
B. �����������ˮ�������ǿ����������H2O2���������������ӡ���������ӵȣ����Գ�ȥ��ͬʱ������NO���壬���Բ���ڲ�������ˮ�������ǿ����������H2O2����B��ȷ��
C. �����Ϊ���ˣ�����ͭ��Һ������ͭ���岽��Ӧ��Ϊ����Ũ������ȴ�ᾧ�����������ᾧ�����Բ���������ᾧ����C����
D. CuCO3��CuO������Һ��H+��Ӧ��������ҺpH�����ã����������µ����ʣ���D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijʵ��С����̽��Na2CO3��NaHCO3�����ʣ�����ʵ������ʢ�����ֹ�����Լ�ƿ��ʧ�˱�ǩ�����ǣ������ȶԹ���A��B���м�����ͨ��ʵ���������̽����
��1���ֱ���ȹ���A��B�����ֹ���A���Ȳ�����������ʹ����ʯ��ˮ����ǣ�A���ȷֽ�Ļ�ѧ����ʽΪ_____��
��2����ȡ���ֹ����2g���ֱ��������С�ձ��У��ٸ���10mL ����ˮ�����ָ������£�����Na2CO3������ȫ�ܽ⣬��NaHCO3������ʣ�࣬�ɴ˵ó�����_____��
��3����ͼ��ʾ�������������õ�װ�â�͢��зֱ����ҩƷ���������ڵĹ���ͬʱ�����Թ��У�
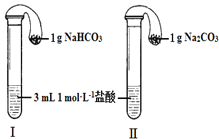
�����Թ��о��������壬_____���������������������ķ�Ӧ�̶ȸ�Ϊ���ң�
�ڷ�Ӧ����������������ͣ��ָ������£�����˵����ȷ����_____��
a װ�� I����������ϴ� b װ�â����������ϴ�
c װ�� I�������������װ�â��������� d ���ж�
��4��ͬѧ�ǽ����ֹ���ֱ����Ƴ�0.5molL��1����Һ��������·������Է�Ӧ��������Ԥ�⣺
ʵ�鷽�� | Ԥ������ | Ԥ������ |
����1����2mL Na2CO3��Һ�еμ�1mL 0.5molL��1CaCl2��Һ | �а�ɫ���� | Na2CO3��Һ�е�CO32��Ũ�Ƚϴ�����CaCl2������Ӧ__________��д���ӷ���ʽ���� |
����2����2mL NaHCO3��Һ�еμ�1mL 0.5molL��1CaCl2��Һ | �ް�ɫ���� | Na2CO3��Һ�е�CO32��Ũ�Ⱥ�С��������CaCl2������Ӧ�� |
����1��Ӧ�����ӷ���ʽΪ________________��ʵʩ������ֲ���2��������Ԥ���в��죬������ɫ���������壬��������£�NaHCO3��Һ��CaCl2��Һ��Ӧ�����ӷ���ʽΪ____________.