题目内容
【题目】含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____;基态Cu+的核外电子排布式为_____。
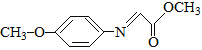
(2)化合物(CH3)3N分子中N原子杂化方式为_____,该物质能溶于水的原因是_____。
(3)PH3分子的键角小于NH3分子的原因是_____;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
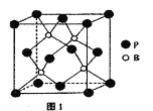
①在一个晶胞中磷原子的配位数为_____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为_____。
【答案】哑铃形 [Ar]3d10 sp3 (CH3)3N为极性分子,且可与水分子间形成氢键
(CH3)3N为极性分子,且可与水分子间形成氢键 电负性N>P,成键电子对离中心原子越近,成键电子对之间的排斥力越大,键角变大 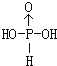 4
4 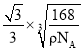
【解析】
(1)s能级电子云形状为球形、p能级电子电子云形状为哑铃形;Cu失去4s能级电子生成Cu+,根据构造原理书写该离子核外电子排布式;
(2)化合物(CH3)3N分子中N和每个C原子形成一个共价键,且还含有一个孤电子对,所以N原子价层电子对个数为4,根据价层电子对互斥理论判断N原子杂化方式;极性分子的溶质易溶于极性分子的溶剂,能和水形成氢键的溶质易溶于水;
(3)电负性N>P,键合电子对偏向N,成键电子对间斥力增大;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,说明为二元酸,则该分子中含有2个羟基,一个H原子和P原子形成共价键;
(4)①在一个晶胞中磷原子的配位数为4;
②该晶胞中P原子个数=8×![]() +6×
+6×![]() =4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=
=4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=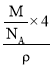 =
=![]() ,其棱长=
,其棱长=![]() ,B-P键长为体对角线的
,B-P键长为体对角线的![]() 。
。
(1)s能级电子云形状为球形、p能级电子电子云形状为哑铃形,基态B原子电子占据最高能级的电子为2p电子,其电子云轮廓图为哑铃形;Cu失去4s能级电子生成Cu+,根据构造原理书写该离子核外电子排布式为[Ar]3d10;
(2)化合物(CH3)3N分子中N和每个C原子形成一个共价键,且还含有一个孤电子对,所以N原子价层电子对个数为4,根据价层电子对互斥理论判断N原子杂化方式为sp3;极性分子的溶质易溶于极性分子的溶剂,能和水形成氢键的溶质易溶于水,(CH3)3N为极性分子,且可与水分子间形成氢键;
(3)电负性N>P,键合电子对偏向N,成键电子对间斥力增大,键角增大;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,说明为二元酸,则该分子中含有2个羟基,一个H原子和P原子形成共价键,其结构式为 ;
;
(4)①在一个晶胞中磷原子的配位数为4;
②该晶胞中P原子个数=8×![]() +6×
+6×![]() =4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=
=4、B原子个数为4,磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则晶胞体积=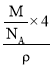 =
=![]() ,其棱长=
,其棱长=![]() ,,B-P键长为体对角线的
,,B-P键长为体对角线的![]() =
=![]() ×
×![]() ×
×![]() cm=
cm=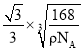 cm。
cm。

 考前必练系列答案
考前必练系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D