题目内容
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是: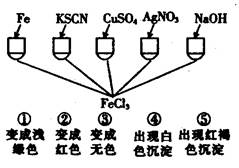
| A.只有④ |
| B.只有③ |
| C.③和④均错 |
| D.全部错误 |
C
解析试题分析:①Fe与FeCl3溶液反应的离子方程式为:Fe + 2Fe3+ = 3Fe2+,溶液由棕黄色变为浅绿色,正确;②KSCN与FeCl3溶液反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3,溶液由棕黄色变为红色,正确;③硫酸铜与与FeCl3溶液不反应,溶液不会变为无色,错误;④硝酸银与FeCl3溶液反应的离子方程式为:Cl- + Ag+ =AgCl↓,产生白色沉淀,但不是Fe3+的性质,错误;⑤氢氧化钠与FeCl3溶液反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓,出现红褐色沉淀,正确;综上所述,选C。
考点:考查Fe3+的性质及实验方案的评价。

下列各组物质相互反应能得到Al(OH)3的是
| A.铝与NaOH溶液反应 | B.AlCl3与过量的氨水反应 |
| C.AlCl3与过量的NaOH溶液反应 | D.Al2O3与过量的NaOH溶液反应 |
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是
| A.参加反应的H2SO4为0.2mol | B.参加反应的NaOH约为0.27mol |
| C.加入铝粉的质量A=5.4 | D.与硫酸反应的铝粉的质量7.2g |
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJ?mol-1
下列表述正确的是(NA代表阿伏伽德罗常数的数值)
| A.1molCO燃烧时放出的热量为283 kJ?mol-1 |
| B.Na2O2(s)+CO(g) = Na2CO3(s)ΔH= -509 kJ?mol-1 |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
在25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,得b克固体 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。 |
| D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
在潜水艇中用于氧气来源的是( )
| A.高压氧气瓶 | B.NaOH | C.Na2O2 | D.Na2CO3 |
取16.8g碳酸氢钠固体,加热一段时间后,剩余固体的质量为13.7g。把剩余固体加入到100mL 2mol/L的稀硫酸中,充分反应后溶液中H+的浓度约为
| A.3 mol/L | B.2 mol/L | C.1.4 mol/L | D.1 mol/L |
下列关于碳酸钠和碳酸氢钠的叙述正确的是
| A.相同条件下,在水中的溶解性:碳酸钠 < 碳酸氢钠 |
| B.相同条件下,热稳定性:碳酸钠 > 碳酸氢钠 |
| C.相同条件下,与酸反应的速率:碳酸钠 > 碳酸氢钠 |
| D.一定条件下,碳酸钠不能转化为碳酸氢钠,而碳酸氢钠可以转化为碳酸钠 |