题目内容
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,得b克固体 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。 |
| D.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
D
解析试题分析:A.根据反应前后的质量差来计算NaHCO3的质量,进而计算出Na2CO3的质量和质量分数。正确。B.根据Na2CO3和NaHCO3的质量和及与盐酸反应产生的氯化钠的质量能计算出各自的质量。进而计算出Na2CO3的质量分数。正确。C.根据Na2CO3和NaHCO3的质量和及与足量Ba(OH)2溶液盐酸反应产生的碳酸钡的质量能计算出各自的质量。进而计算出Na2CO3的质量分数。正确。D.混合物与足量稀硫酸充分反应,逸出气体中含有二氧化碳和水蒸气两种。故用碱石灰吸收不能知道每种气体的质量,故不能计算出Na2CO3的质量和质量分数。错误。
考点:考查混合物中某成分含量的测定方法的知识。

 名校课堂系列答案
名校课堂系列答案由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐溶液与烧碱反应制的白色纯净的Fe(OH)2沉淀。应用如图所示的电解实验可制得白色纯净Fe(OH)2沉淀,两电极的材料分别为石墨和铁。下列说法正确的是( )
| A.a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B.为了在较短时间内看到白色沉淀,可适当加大电压 |
| C.c可以是氯化钠溶液,d可以是苯 |
| D.为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
| A.Na2O2和NaHCO3 | B.NaHCO3和Na2CO3 |
| C.NaOH和Na2CO3 | D.只有Na2CO3 |
有关钠的叙述不正确的是( )
| A.少量钠应保存在煤油中,实验后剩余的钠需放回原瓶 |
| B.2.3g钠与97.7g 水反应后溶液中溶质的质量分数大于4% |
| C.钠与CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出的金属铜 |
| D.用一般的化学还原法不能制取金属钠,但可用电解熔化NaCl的方法制得 |
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是:
| A.只有④ |
| B.只有③ |
| C.③和④均错 |
| D.全部错误 |
为测定某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100 mL 0.3 mol?L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol?L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005 mol | B.0.010 mol | C.0.020 mol | D.0.030 mol |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的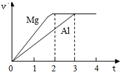
| A.物质的量之比为3:2 | B.质量之比为3:2 |
| C.摩尔质量之比为2:3 | D.反应速率之比为2:3 |
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
| A.合金的熔点一般比组分金属低 |
| B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
下列关于铝及其化合物的说法不正确的是
| A.Al既可用于食品包装,也可用做建筑材料 |
| B.Al2O3既可用来冶炼金属Al,也可用做耐火材料 |
| C.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂 |
| D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐 |